Электроотрицательность
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ, величина, характеризующая способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А — В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А.
Л. Полинг предложил (1932) для количеств. характеристики электроотрицательности использовать термохим. данные об энергии связей А—А, В — В и А — В - соотв. ЕАА, Евв и ЕАВ. Энергия гипотетической чисто ковалентной связи А — В (Еков) принимается равной среднеарифметич. или среднегеометрич. значению величин EAA и ЕВВ. Если электроотрицательности атомов А и В различны, то связь А — В перестает быть чисто ковалентной и энергия связи ЕАВ станет больше Ековна величину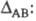
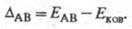
Чем больше различие электроотрицательностей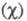 атомов А и В, тем больше величина
атомов А и В, тем больше величина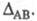 Используя эмпирич. ф-лу
Используя эмпирич. ф-лу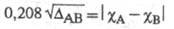 (множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности
(множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности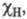 равное 2,1, Полинг получил удобную шкалу относит. числовых значений электроотрицательности, часть к-рых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
равное 2,1, Полинг получил удобную шкалу относит. числовых значений электроотрицательности, часть к-рых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
Для количеств. описания электроотрицательности, помимо термохим. данных, используют также данные о геометрии молекул (напр., метод Сандерсона), спектральные характеристики (напр., метод Горди).
