Бора трифторид
БОРА ТРИФТОРИД BF3, бесцв. газ с удушливым запахом, дымящий во влажном воздухе. Молекула плоская, длина связи В—F 0,1295 нм, угол FBF 120°, энергия диссоциации 1920 кДж/моль. Т. пл. — 128,36°С, т. кип. -100,3°С; плотн. 0,00307 г/см3 (20 °С), твердого - 1,87 г/см3 ( - 130°С); tкрит - 12,3 °С, pкрит 49,8*105 Па; Сp° 50,5 Дж/(моль*К); Hoпл4,62 кДж/моль,
Hoпл4,62 кДж/моль,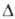 Hoисп 17,1 кДж/моль,
Hoисп 17,1 кДж/моль,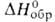 - 1119 кДж/моль; Sо298 254,3 Дж/(моль*К); ур-ния температурных зависимостей плотности жидкого BF3 и давления пара над жидким BF3: d(кг/м3) = 1699 - 4,45(t+125) (-124,3
- 1119 кДж/моль; Sо298 254,3 Дж/(моль*К); ур-ния температурных зависимостей плотности жидкого BF3 и давления пара над жидким BF3: d(кг/м3) = 1699 - 4,45(t+125) (-124,3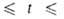 102,4°С); lg p(Пa)= 10,1785- 1174,4/7+ 1,75 lg T - 0,013350Т (145,9
102,4°С); lg p(Пa)= 10,1785- 1174,4/7+ 1,75 lg T - 0,013350Т (145,9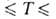 170,3 К).
170,3 К).
Бора трифторид раств. в воде (332,1 г в 100 г Н2О при 0°С, 772 МПа, с частичным гидролизом), водных р-рах HF (с образованием Н [BF4]), многих орг. р-рителях. Образует неустойчивые выше 20 °С моногидрат (т. пл. 10,18 °С) и дигидрат (т. пл. 6,36 °С).
Бора трифторид - сильная к-та Льюиса. Образует аддукты со спиртами, эфирами, альдегидами, кетонами, орг. основаниями, неорг. и орг. к-тами. Получают взаимод. В или его соед. с F2, а также по р-циям:
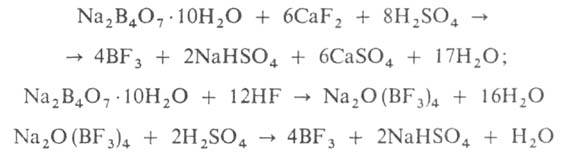
Вместо Na2B4O7 м. б. использован СаВО4. Применяют как катализатор многих орг. р-ций, в кач-ве наполнителя в счетчиках нейтронов. Бора трифторид токсичен, ПДК 1 мг/м3.
Эфират (С2Н5)2О*BF3 - бесцв. жидкость; т. пл. -60,4°С, т. кип. 125°С (с разл.); d425 1,125; nD20 1,348;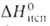 54,39 кДж/моль (298 К),
54,39 кДж/моль (298 К),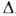 Hoобр жидкого - 352,8 кДж/моль (298 К). Гидролизуется водой.
Hoобр жидкого - 352,8 кДж/моль (298 К). Гидролизуется водой.
Анизолят С6Н5ОСН3*BF3 - бесцв. жидкость; т. пл. 2°С; d425 1,207. Разлагается ок. 25°С. Гидролизуется водой; раств. в анизоле. Применяют как рабочее тело при разделении изотопов В.
Литература
Топчиев А. В., Завгородний С. В., Паушкин Я. М., Фтористый бор и его соединения как катализаторы в органической химии, М., 1956; Greenwood N. N., The chemistry of boron, Oxf., 1975 (Pergamon texts in inorganic chemistry, v. 8). Э. Г. Раков, С. Г. Катальников.
