Ферменты
ФЕРМЕНТЫ (от лат. fermentum - закваска) (энзимы), белки, выполняющие роль катализаторов в живых организмах. Осн. ф-ции ферментов- ускорять превращение в-в, поступающих в организм и образующихся при метаболизме (для обновления клеточных структур, для обеспечения его энергией и др.), а также регулировать биохим. процессы (напр., реализацию ге-нетич. информации), в т. ч. в ответ на изменяющиеся условия.
О механизме р-ций с участием ферментов (ферментативных р-циях) см. Ферментативный катализ, Ферментативных реакций кинетика.
Структуру ферментов изучают методами хим. модификации, рентгеновского структурного анализа, спектроскопии. Ценные результаты получены методом сайт-специфичного мутагенеза, основанного на направленной замене аминокислот в белковой молекуле методами генетической инженерии. К кон. 20 в. известно и охарактеризовано ок. 3000 ферментов.
Исторический очерк. Начало совр. науки о ферментах (энзимоло-гии) связывают с открытием в 1814 К. Кирхгофом превращения крахмала в сахар под действием водных вытяжек из проростков ячменя. Действующее начало из этих вытяжек было выделено в 1833 А. Пайеном и Ж. Персо. Им оказался фермент амилаза. В 1836 T. Шванн обнаружил и описал пепсин, в том же году И. Пуркин и И. Паппенгейм охарактеризовали трипсин. В 1897 братья Г. и Э. Бухнеры выделили из дрожжей р-римый препарат (т. наз. зимазу), вызывавший спиртовое брожение. Этим был положен конец спору Л. Пастера (он полагал, что процесс брожения могут вызывать только целостные живые клетки) и Ю. Либиха (считал, что брожение связано с особыми в-вами). В кон. 19 в. Э. Фишер предложил первую теорию специфичности ферментов. В 1913 Л. Михаэлис сформулировал общую теорию кинетики ферментативных р-ций. В кристаллич. виде первые ферменты были получены Дж. Самнером в 1926 (уреаза) и Дж. Нортропом в 1930 (пепсин). Впервые первичная структура (аминокислотная последовательность) ферментов была установлена У. Стейном и С. Муром в 1960 для рибонуклеазы А, а в 1969 P. Меррифилдом осуществлен хим. синтез этого фермента. Пространственное строение (третичная структура) ферментов впервые установлено Д. Филлипсом в 1965 для лизоцима. Во 2-й пол. 20 в. каталитич. активность была открыта также у нек-рых РНК (их наз. рибозимы).
Классификация ферментов. Исторически многим ферментам присваивались тривиальные названия, часто не связанные с типом катализируемой р-ции. Для преодоления возникших трудностей в сер. 20 в. были разработаны классификации и номенклатура ферментов. По рекомендации Международного биохим. союза, все ферменты в зависимости от типа катализируемой р-ции делят на 6 классов: 1-й - оксидоредуктазы, 2-й - трансферазы, 3-й - гидролазы, 4-й - лиазы, 5-й - изомеразы и 6-й - лигазы. Каждый класс делится на подклассы, в соответствии с природой функц. групп субстратов, подвергающихся хим. превращению. Подклассы, в свою очередь, делятся на подпод-классы в зависимости от типа участвующего в превращении фермента. Каждому достаточно охарактеризованному ферменту присваивается классификационный номер из 4 цифр, обозначающих класс, подкласс, подподкласс и номер самого ферменты Напр., a-химотрипсин имеет номер 3.4.21.1.
К оксидоредуктазам относятся ферменты, катализирующие окислит.-восстановит. р-ции. Ферменты этого типа переносят атомы H или электроны. Многие оксидоредуктазы являются ферментами дыхания и окислительного фосфорилирования.
Трансферазы катализируют перенос функц. групп (CH3, COOH, NH2, CHO и др.) от одной молекулы к другой.
Гидролазы катализируют гидролитич. расщепление связей (пептидной, гликозидной, эфирной, фосфодиэфирной и др·)·
Л и а з ы катализируют негидролитич. отщепление групп от субстрата с образованием двойной связи и обратные р-ции. Эти ферменты могут отщеплять CO2, H2O, NH3 и др.
Изомеразы катализируют образование изомеров субстрата, в т. ч. цис-, транс-изомеризацию, перемещение кратных связей, а также групп атомов внутри молекулы.
Л и г а з ы - ферменты, катализирующие присоединение двух молекул с образованием новых связей (С — С, С — S, С — О, С — N и др.), как правило, сопряженное с расщеплением пирофос-фатной связи, напр. у АТФ.
Особенности строения ферментов. Мол. масса ферментов составляет от 104 до 1010 и более. Чаще всего встречаются ферменты с мол. м. 20-60 тыс., более крупные обычно состоят из неск. одинаковых (гомомеры) или разных (гетеромеры) субьеди-ниц, связанных между собой нековалентными связями. Субъединица может состоять из двух и более цепей, соединенных дисульфидными связями.
В первичной структуре однотипных ферментов, выделенных даже из эволюционно отдаленных организмов, часто наблюдается определенная гомология, а нек-рые участки практически остаются неизменными. Вторичная структура отличается большим разнообразием по содержанию 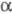 -спиралей и
-спиралей и 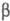 -структур (см. Белки).
-структур (см. Белки). 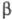 -Структуры составляют ядро многих ферментов, образуя "опорную" структуру. Совокупность стандартных элементов вторичных структур и специфически уложенных участков полипептидной цепи, определенным образом расположенных в пространстве, образует третичную структуру, определяющую биол. св-ва ферментов.
-Структуры составляют ядро многих ферментов, образуя "опорную" структуру. Совокупность стандартных элементов вторичных структур и специфически уложенных участков полипептидной цепи, определенным образом расположенных в пространстве, образует третичную структуру, определяющую биол. св-ва ферментов.
Третичная структура уникальна для каждого фермента, однако у однотипных ферментов, даже сильно отличающихся по первичной структуре, пространственное расположение цепей м. б. сходным (напр., химотрипсины и субтилизины). Часто в третичной структуре можно выделить отдельные компактные части (домены), соединенные участками полипептидной цепи. Организация в пространстве неск. субъединиц определяет четвертичную структуру ферментов.
На пов-сти белковой глобулы фермента или, чаще, в спец. щели, углублении и т. п. выделяют относительно небольшой участок, наз. активным центром. Он представляет собой совокупность функц. групп аминокислотных остатков, непосредственно взаимодействующих с субстратом. В активный центр фермента, кроме функц. групп, могут входить небелковые составляющие - коферменты. Такой комплекс наз. х о л о -ферментом, а его белковую часть - апоферментом. Аминокислотные остатки, входящие в активный центр, относятся к наиб. консервативным в данной группе ферментов. В активном центре можно выделить субстрат-связывающий участок и собственно каталитически активные группы ферментов. К последним, напр., в подподклассе сериновых протеаз относятся функц. группы остатков серина-195, гистидина-57 и аспарагиновой к-ты-102. Кроме того, в качестве каталитически активных групп ферментов выступают группа SH цистеина, группа COOH глугаминовой к-ты, фенольный гидроксил тирозина и др., а также функц. группы коферментов - никотинамидное кольцо никотинамидных коферментов (см. Ниацин), альдегидная группа (в виде альдимина) пиридоксальфосфата, тиазолино-вое кольцо тиаминпирофосфата, ионы металлов (напр., Zn2+, Co2+, Mn2+) и др.
Получение ферментов. Обычно ферменты вьделяют из тканей животных, растений, клеток и культуральных жидкостей микроорганизмов, биол. жидкостей (кровь, лимфа и др.). Для получения нек-рых труднодоступных ферментов используются методы генетической инженерии. Из исходных материалов ферменты экстрагируют солевыми р-рами. Затем их разделяют на фракции, осаждая солями [обычно (NH4)2SO4] или, реже, орг. р-рителями, и очищают методами гель-проникающей и ионо-обменной хроматографии. На заключит. этапах очистки часто используют методы аффинной хроматографии. Контроль за ходом очистки ферментов и характеристику чистых препаратов осуществляют, измеряя каталитич. активность ферментов с применением специфических (обычно дающих цветные р-ции) субстратов. За единицу кол-ва фермента принимают такое его кол-во, к-рое катализирует превращение 1 мкмоля субстрата в 1 мин в стандартных условиях. Число единиц фермента, отнесенное к 1 мг белка, наз. удельной активностью.
Применение ферментов. В неочищенном состоянии ферменты с древнейших времен используют для получения продуктов питания и выделки изделий в хлебопечении, сыроделии, виноделии, обработке кож и т. д. Достаточно очищенные ферменты применяют в произ-ве аминокислот и их смесей для искусственного питания, в произ-ве сахарных сиропов из углеводсо-держащего сырья, для удаления лактозы из молока и в произ-ве ряда лек. ср-в (нек-рые очищенные ферменты сами используются как лек. ср-ва). Особенно перспективно применение в пром-сти иммобилизованных ферментов на полимерных носителях (напр., для получения полусинтетич. пеницилли-нов применяют иммобилизованную пенициллинамидазу, см. также Ферментсодержащие волокна). Об использовании ферментов в хим. анализе см. Ферментативные методы анализа.
Лит.: Номенклатура ферментов (Рекомендации 1972), пер. с англ., M., 1979; Фершт Э., Структура и механизм действия ферментов, пер. с англ., M., 1980; Диксон M., Уэбб Э., Ферменты, пер. с англ., т. 1-3, M., 1982; Methods in enzymology, eds. S. P. Colowick, N. O. Kaplan, N. Y.- S. F.- L., 1955.
В. К. Антонов.
