Активирование и ингибирование ферментов
Скорость ферментативной реакции, как и активность фермента, в значительной степени определяется также присутствием в среде активаторов и ингибиторов: первые повышают скорость реакции, а вторые тормозят эту реакцию. Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Так, соляная кислота активирует действие пепсина желудочного сока;
желчные кислоты повышают активность панкреатической липазы; некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), растительная протеиназа и др. в значительной степени активируются соединениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд ферментов – также витамином С. Особенно часто активаторами выступают ионы двухвалентных и, реже, одновалентных металлов. Получены доказательства, что около четверти всех известных ферментов для проявления полной каталитической активности нуждаются в присутствии металлов. Многие ферменты вообще не активны в отсутствие металлов. Так, при удалении цинка угольная ангидраза (карбоангидраза), катализирующая биосинтез и распад Н2СО3, практически теряет свою ферментативную активность; более того, цинк при этом не может быть заменен никаким другим металлом. Известны ферменты , действие которых активируется ионами нескольких металлов; в частности, енолаза активируется Mg2+, Mn2+, К+ (табл. 4.4).
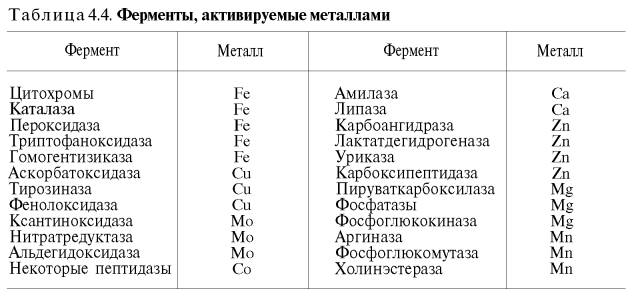
Молекулярный механизм действия металлов в энзиматическом катализе, или роль металлов в активировании ферментами. В ряде случаев ионы металлов (Со2+, Mg2+, Zn2+, Fe2+) выполняют функции простетических групп ферментов, или служат акцепторами и донаторами электронов, или выступают в качестве электрофилов либо нуклеофилов, сохраняя реактивные группы в необходимой ориентации. В других случаях они способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса. Например, ионы Mg2+через отрицательно заряженную фосфатную группу обеспечивают присоединение монофосфатных эфиров органических веществ к активному центру фосфатаз, катализирующих гидролиз этих соединений. Иногда металл соединяется с субстратом, образуя истинный субстрат, на который действует фермент. В частности, ионы Mg2+активируют креатинфосфокиназу благодаря образованию истинного субстрата – магниевой соли АТФ. Наконец, имеются экспериментальные доказательства прямого участия металлов (например, ионов Са2+ в молекуле амилазы слюны) в формировании и стабилизации активного центра и всей трехмерной структуры молекулы фермента. Следует отметить также, что металлы нередко выступают в роли аллостерических модуляторов (эффекторов; см. рис. 4.22). Взаимодействуя с аллостеричес-ким центром, подобный металл (эффектор) способствует образованию наиболее выгодной пространственной конфигурации фермента и активного фермент-субстратного комплекса.
Анионы в физиологических концентрациях обычно неэффективны или оказывают небольшое активирующее влияние на ферменты. Исключение составляют пепсин, некоторые оксидоредуктазы, активируемые анионами, а также амилаза слюны, катализирующая гидролиз крахмала, активность которой повышается при действии ионов хлора, и аденилатциклаза, которая активируется анионами галогенов.
Ингибиторы ферментов обычно принято делить на два больших класса: обратимые и необратимые. Это вещества, вызывающие частичное (обратимое) или полное торможение реакций, катализируемых ферментами. Недавно открыты антиферменты (антиэнзимы, или антизимы), представляющие собой белки (или полипептиды), действующие как ингибиторы ферментов. К подобным веществам относятся, например, ингибитор трипсина, обнаруженный в соевых бобах, и сывороточный антитрипсин. Недавно открыт в печени животных антифермент орнитинде-карбоксилазы (см. главу 12). Антизимы, вероятнее всего, образуют трудно-диссоциируемые комплексы с соответствующими ферментами, выключая их из химических реакций. Иногда ингибитор является составным компонентом предшественника фермента, например пепсина (см. главу 12), или входит в состав сложных комплексов ферментов, например в состав протеинкиназы и протеинфосфатазы, катализирующих процессы фосфо-рилирования-дефосфорилирования в живых организмах. Однако до сих пор не выяснено, являются ли подобные антиферменты истинными ингибиторами или регуляторными субъединицами, в частности, какова разница в назначении регуляторной (R) субъединицы в составе протеинкиназы и ингибиторной (I) субъединицы в составе протеинфосфатазы.
Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка (кислоты, щелочи, соли тяжелых металлов, нагревание), приводят к необратимой инактивации фермента. Однако подобное инак-тивирование относительно неспецифично, оно не связано с механизмом действия ферментов. Гораздо большую группу составляют так называемые специфические ингибиторы, которые оказывают свое действие на какой-либо один фермент или группу родственных ферментов, вызывая обратимое или необратимое ингибирование. Исследование этих ингибиторов имеет важное значение. Во-первых, ингибиторы могут дать ценную информацию о химической природе активного центра фермента, а также о составе его функциональных групп и природе химических связей, обеспечивающих образование фермент-субстратного комплекса. Известны вещества, включая лекарственные препараты, специфически связывающие ту или иную функциональную группу в молекуле фермента, выключая ее из химической реакции. Так, йодацетат IСН2—СООН, его амид и этиловый эфир, пара-хлормеркурибензоат ClHg—С6Н4—СООН и другие реагенты сравнительно легко вступают в химическую связь с некоторыми SH-группами ферментов. Если такие группы имеют существенное значение для акта катализа, то добавление подобных ингибиторов приводит к полной потере активности фермента:
R-SH + IСН2—СООН —> НI + R—S—CH2—COOH
Действие ряда других ферментов (холинэстераза, трипсин и химотрип-син) сильно тормозится некоторыми фосфорорганическими соединениями, например ДФФ, вследствие блокирования ключевой гидроксильной группы серина в активном центре (см. ранее).
Во-вторых, ингибиторы нашли широкое применение в энзимологии при исследовании природы множественных форм ферментов и изоферментов, различающихся не столько электрофоретической подвижностью, сколько различной чувствительностью к одному и тому же ингибитору.
При помощи ингибиторов, выключающих отдельные стадии многоступенчатого метаболического процесса, могут быть точно установлены не только последовательность химических реакций, но и природа участвующих в этих превращениях ферментов. Этим путем, применяя йодацетат, фториды и другие специфические ингибиторы, был расшифрован глико-литический путь окислительно-восстановительных превращений глюкозы до стадии образования молочной кислоты в мышечной ткани, насчитывающий 11 стадий с участием 11 ферментов и 10 промежуточных метаболитов.
С ингибированием ферментов связан механизм действия многих токсинов и ядов на организм. Известно, что при отравлениях солями сенильной кислоты смерть наступает вследствие полного торможения и выключения дыхательных ферментов (цитохромная система) тканей, особенно клеток мозга. Токсическое влияние на организм человека и животных некоторых инсектицидов обусловлено торможением активности холинэстеразы – фермента, играющего ключевую роль в деятельности нервной системы.
Современная, так называемая рациональная, химиотерапия (направленное применение лекарственных препаратов в медицине) должна основываться на точном знании механизма действия лекарственных средств на биосинтез ферментов, на активность уже синтезированных ферментов или на регуляцию их активности в организме. Иногда для лечения некоторых болезней используют избирательно действующие ингибиторы. Так, ингибитор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол широко применяется для лечения острого панкреатита – болезни, при которой уровень трипсина и химотрипсина в крови резко возрастает. Знание избирательного ингибиторного действия некоторых природных и синтетических соединений (так называемых антиметаболитов) на ферменты может служить методологической основой для разработки эффективных методов синтеза химиотерапевтических препаратов. Этот путь открывает широкие возможности для направленного воздействия на синтез ферментов в организме и регуляции интенсивности метаболизма при патологии.
Типы ингибирования. Различают обратимое и необратимое ингибиро-вание. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую:
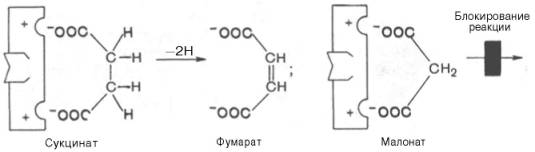
Если в среду добавить малонат (ингибитор), то в результате структурного сходства его с истинным субстратом сукцинатом (наличие двух таких же ионизированных карбоксильных групп) он будет взаимодействовать с активным центром с образованием фермент-ингибиторного комплекса, однако при этом полностью исключается перенос атома водорода от малоната. Структуры субстрата (сукцинат) и ингибитора (малонат) все же несколько различаются. Поэтому они конкурируют за связывание с активным центром, и степень торможения будет определяться соотношением концентраций малоната и сукцината, а не абсолютной концентрацией ингибитора. Таким образом, ингибитор может обратимо связываться с ферментом, образуя фермент-ингибиторный комплекс. Этот тип ингиби-рования иногда называют ингибированием по типу метаболического антагонизма (рис. 4.20).
В общей форме реакция взаимодействия ингибитора с ферментом может быть представлена следующим уравнением:
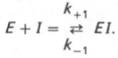
Образовавшийся комплекс, называемый фермент-ингибиторным комплексом ЕI, в отличие от фермент-субстратного комплекса ES не распадается с образованием продуктов реакции. Константу диссоциации комплекса EI, или ингибиторную константу Кi, можно, следуя теории Михаэлиса–Мен-тен, определить как отношение констант обратной и прямой реакций:
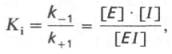
т.е. ингибиторная константа прямо пропорциональна произведению концентрации фермента и ингибитора и обратно пропорциональна концентрации комплекса EI.
Метод конкурентного торможения нашел широкое применение в медицинской практике. Известно, например, что для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Оказалось, что эти препараты имеют структурное сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, являющейся составной частью
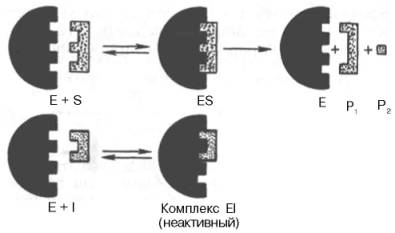
Рис. 4.20. Действие конкурентного ингибитора (схема по В.Л. Кретовичу). Е - фермент; S - субстрат; Р1 и Р2 - продукты реакции; I - ингибитор.
ферментов бактерий. Благодаря этому структурному сходству сульфаниламид блокирует действие фермента путем вытеснения парааминобензой-ной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту, что ведет к торможению роста бактерий.
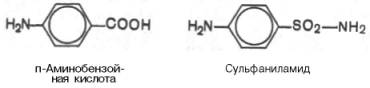
Некоторые аналоги витамина В6 и фолиевой кислоты, в частности дезоксипиридоксин и аминоптерин (см. главу 7), действуют как конкурентные, так называемые коферментные, ингибиторы (или антивитамины), тормозящие многие интенсивно протекающие при патологии биологические процессы в организме. Применение подобных аналогов в медицинской практике (в частности, в дерматологии и онкологии) основано на конкурентном вытеснении коферментов из субстратсвязывающих центров ключевых ферментов обмена.
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примером необратимого ингибирования является действие йодацетата, ДФФ, а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов и молекуле фермента.
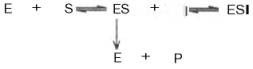
Следует указать, что неконкурентное ингибирование также может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр. Примеры необратимого ингибирования приведены ранее. При обратимом неконкурентном ингибировании субстрат S и ингибитор I связываются с разными центрами, поэтому появляется возможность образования как комплекса EI, так и тройного комплекса EIS; последний может распадаться с освобождением продукта, но с меньшей скоростью, чем комплекс ES.
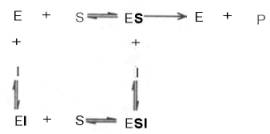
Этот тип неконкурентного ингибирования чаще всего наблюдается у ферментов, катализирующих превращения более одного субстрата, когда связывание ингибитора не блокирует связывание субстрата с активным центром. Ингибитор при этом соединяется как со свободным ферментом, так и с ES-комплексом.
Известно, кроме того, так называемое бесконкурентное ингиби-рование, когда ингибитор связывается с ферментом также в некаталитическом центре, однако не со свободным ферментом, а только с ES-комплексом в виде тройного комплекса.
Для выяснения вопроса о типе ингибирования пользуются уравнениями Михаэлиса-Ментен, Лайнуивера-Бэрка или другими, например уравнением Эди-Хофсти:
ν = -Km(y/[S]) + Vmax
и соответствующими графиками в прямолинейных координатах.
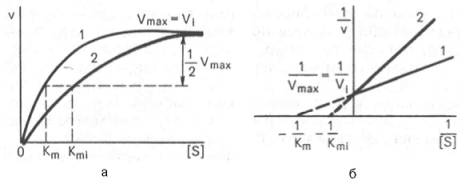
Рнс. 4.21. Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора.
а - в координатах v от [ S ] ; б - в координатах 1/v от 1 / [ S ] ; Vmaxи Vi - максимальные скорости реакции; Кm и Kmi - константа Михаэлиса соответственно в отсутствие (1) и в присутствии (2) ингибитора.
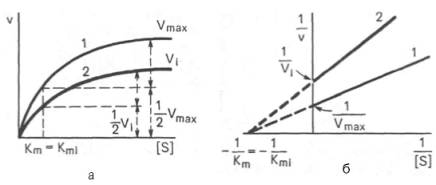
Рис. 4.22. Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора. Обозначения те же, что на рис. 4.21.
При конкурентном типе ингибирования ингибитор увеличивает значение Кm, не оказывая влияния на максимальную скорость Vmax(рис. 4.21). Это означает, что при достаточно высокой концентрации субстрата [ S ] ингибитор вытесняется молекулами субстрата из комплекса EI. При неконкурентном ингибировании (рис. 4.22) ингибитор снижает величину максимальной скорости. Если при этом величина Кm не уменьшается, то говорят о полностью неконкурентном ингибировании. Подобный тип ингибиро-вания имеет место при образовании неактивных, труднодиссоциирующих комплексов EI и(или) EIS. Часто, однако, наблюдается смешанный тип ингибирования, иногда называемый частично неконкурентным, или обратимым неконкурентным ингибированием (см. ранее), при котором снижение Vmaxсочетается с одновременным увеличением значений Кm. Это означает, что комплекс EI сохраняет частичную активность, т.е. способность к образованию промежуточного тройного комплекса EIS, в котором субстрат подвергается замедленному каталитическому превращению. В редких случаях степень торможения активности фермента может увеличиваться с повышением концентрации субстрата. Для этого типа торможения был предложен, как отмечено ранее, довольно неточный термин «бесконкурентное ингибирование». Один из механизмов такого торможения обусловлен возможностью соединения ингибитора с комплексом ES с образованием неактивного или медленно реагирующего тройного комплекса EIS.
Таким образом, при графическом анализе скоростей ферментативных реакций как функции концентраций субстрата может быть получена ценная информация не только о кинетике ферментативных реакций, но и о молекулярных механизмах ферментативного катализа.


