Аффинная хроматография
АФФИННАЯ ХРОМАТОГРАФИЯ (от лат. affinis - родственный) (биоспецифич. хроматография, хроматография по сродству), метод очистки и разделения белков, основанный на их избират. взаимод. с лигандом, ковалентно связанным с инертным носителем. В кач-ве лигандов используют соед., взаимод. к-рых с разделяемыми в-вами основано на биол. ф-ции последних. Так, при разделении ферментов (для чего преим. и применяется аффинная хроматография) лигандами служат их субстраты, ингибиторы или коферменты. Главная особенность, к-рая обусловливает высокую эффективность аффинной хроматографии, состоит в том, что разделение основано на различии не физ.-хим. признаков молекулы (заряда, формы и размера), а специфич. функциональных св-в, отличающих данный фермент от множества др. биополимеров.
Неподвижная фаза в аффинной хроматографии представляет собой специально получаемый сорбент, построенный обычно по схеме: носитель - соединяющее звено ("ножка") - специфич. лиганд. Носителем служит чаще всего сефарозапроизводное агарозы, имеющее поперечные сшивки. Присоединение к ней лиганда или "ножки", содержащих, как правило, аминогруппу, осуществляется после активации сефарозы бромцианом:
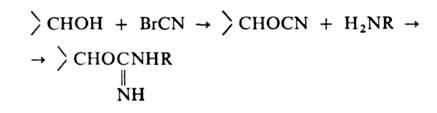
Содержание лиганда колеблется от 0,1 до 10 мкмоль на 1 г влажного сорбента. Сефароза, однако, малоустойчива к действию ряда хим. в-в и микроорганизмов.
Более стабильны макропористые неорг. носители (кремнезем, стекло) и орг. полимеры. Если лиганд присоединяется непосредственно к носителю, эффективность специфич. взаимод. с ферментом заметно снижается вследствие пространств. затруднений. "Ножка", как правило, устраняет стерич. препятствия, отдаляя лиганд от носителя. Как и носитель, она должна быть инертной и не влиять на процессы в ходе аффинной хроматографии, чего, однако, не всегда удается достигнуть. Напр., присоединение "ножки" по приведенной выше р-ции приводит к образованию катионной группировки изомочевины, и сорбент приобретает св-ва анионита. В кач-ве "ножки" используют обычно ди- и полиамины, аминокислоты, пептиды, олигосахариды.
аминокислоты, пептиды, олигосахариды.
Лигандами могут служить субстраты (напр., крахмал или гликоген при разделении амилаз), однако их превращ. в ходе аффинной хроматографии, катализируемое разделяемым ферментом, постоянно изменяет св-ва сорбента. Поэтому, как правило, применяют аналоги субстратов, устойчивые к дальнейшему превращ., т.е. ингибиторы ферментов. Так, для выделения протеиназ используют не расщепляемые ими пептиды D-аминокислот. Эффективны прир. ингибиторы ферментов, напр. пепстатин - ингибитор аспартильных протеиназ. Иногда применяют лиганды, связывающие большие группы родственных ферментов (в частности, киназы и дегидрогеназы). Примеры таких "группоспецифич." лигандов-антрахиноновые красители, аналоги никотинамидадениндину-клеотида.
Известны лиганды (напр., производные фенилборной к-ты), имитирующие при взаимод. с ферментом структуру переходного комплекса с субстратом. Такие лиганды эффективны при выделении сериновых гидролаз.
Разделение в аффинной хроматографии обычно проводят на хроматографич. колонках; иногда разделяемую смесь помещают в сосуд с сорбентом и выдерживают до полного связывания исследуемого компонента. Затем сорбент (в колонке или сосуде) промывают буферным р-ром для удаления несвязавшихся в-в, после чего десорбируют исследуемый компонент. Десорбция (элюция) последнего обычно достигается повышением ионной силы, изменением рН буферного р-ра или добавлением в него орг. р-рителя, что ослабляет взаимод. лиганд - фермент. Более избирательна десорбция р-ром лиганда.
Помимо ферментов, методом аффинной хроматографии можно выделять также токсины, рецепторы, ингибиторы, транспортные белки и др. биологически активные в-ва. Высокой избирательностью отличается т. наз. иммуносорбция, при к-рой в кач-ве лиганда используют антитела, обладающие специфичностью к выделяемым белкам; особенно эффективны моноклональные антитела.
Для разделения белков применяется также ряд др. аналогичных методов. Т. наз. ковалентная хроматография основана на избират. образовании и последующем расщеплении ковалентных связей между выделяемым в-вом и носителем, напр. между белком с SH-группами и ртуть-орг. производными агарозы. Применяется также лигандообменная хроматография, при к-рой ферменты связываются через функциональный ион металла с комплексоном, иммобилизованным на носителе. Получила распространение гидрофобная хроматография, при к-рой сорбент (напр., фенилсефароза), содержащий гидрофобные группировки, вкрапленные в гидрофильную матрицу, взаимодействует с гидрофобными участками, содержащимися на пов-сти белков. Нередко при этом наблюдаются также ионообменные взаимод., как, напр., при использовании в качестве сорбента алкиламиносефароз.
Избират. выделение гликопротеинов обеспечивают иммобилизованные на носителях лектины - белки, специфически взаимодействующие с концевыми моносахаридными звеньями углеводных цепей. Иммобилизованные субъединицы ряда белков с четвертичной структурой м. б. использованы для извлечения этих белков из сложных смесей вследствие специфич. межсубъединичных контактов. Аффинная хроматография сформировалась как метод в кон. 60-х гг. 20 в.
Литература
Туркова Я.. Аффинная хроматография, пер. с англ.. М., 1980. В. М. Степанов.
