Ферментативный анализ
Ферменты играют важную роль в биохимическом анализе. В биологических материалах, например в жидкостях организма, с помощью определения каталитической активности можно обнаружить ферменты в ничтожно малых концентрациях. Ферменты можно использовать как реагенты для определения концентраций метаболитов, например уровня глюкозы в крови (схема В). В большинстве ферментативных анализов применяется фотометрия.
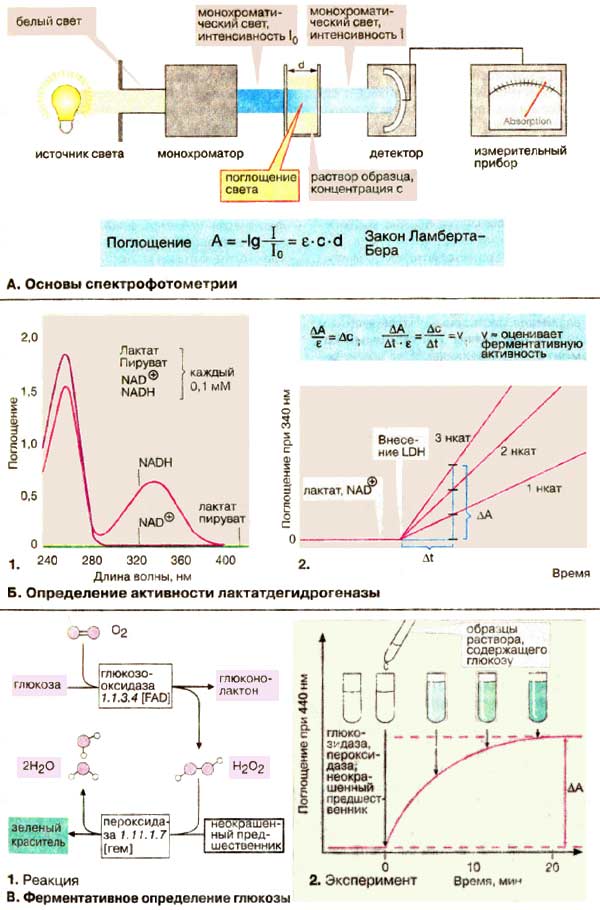
А. Основы спектрофотометрии
Многие молекулы поглощают свет в видимой или ультрафиолетовой области спектра. Это свойство можно использовать для определения концентраций. Величина поглощения зависит от типа и концентрации вещества, а также от длины волны используемого света. Поэтому применяют монохроматический свет, т. е. свет определенной длины волны, который можно выделить из белого света с помощью монохроматора. Монохроматический свет интенсивности I0 проходит через прямоугольную ячейку из стекла или кварца (кювету), в которой находится раствор поглощающего вещества. Интенсивность I выходящего света, ослабленного поглощением, измеряется с помощью детектора. Поглощение света (А) раствора (оптическая плотность) определяется как отрицательный логарифм отношения I / I0. Закон Ламберта-Бера гласит, что А пропорциональна концентрации (с) вещества и толщине (d) слоя раствора. Коэффициент экстинкции ε зависит, как было указано выше, от типа вещества и длины волны.
Б. Определение активности лактатдегидрогеназы
Определение активности лактатдегидрогеназы [ЛДГ (LDH)] основано на том факте, что восстановленный кофермент НАДН + H+ поглощает свет при 340 нм, в то время как у НАД+ (NAD+ ) при этой длине волны поглощение отсутствует. Спектры поглощения (т. е. графики зависимости А от длины волны) субстрата и кофермента в ЛДГ-реакции показаны на рис. Б1.
Различия в поглощении НАД+ и НАДН между 300 и 400 нм обусловлены изменениями никотинамидного кольца при окислении или восстановлении. Для определения активности в кювету помещают прежде всего растворы лактата и НАД+ и регистрируют поглощение при постоянной длине волны 340 нм. Некаталитическая реакция протекает с очень низкой скоростью. Поэтому измеряемые количества НАДН образуются только после добавления ЛДГ. Так как скорость увеличения поглощения ΔA/Δt по закону Ламберта-Бера пропорциональна скорости реакции Δc/Δt, активность ЛДГ можно рассчитать с помощью коэффициента экстинкции ε при 340 нм или путем сравнения со стандартным раствором.
В. Ферментативное определение глюкозы
Большинство биомолекул не поглощают свет в видимой или ультрафиолетовой областях спектра. Кроме того, они обычно присутствуют в смеси с другими соединениями, которые также дают аналогичные химические реакции. Обе трудности можно преодолеть с помощью подходящего фермента для избирательного превращения определяемого метаболита в окрашенное вещество, которое далее определяют по интенсивности поглощения света.
Обычный метод определения глюкозы в крови основан на двух последовательных реакциях:
1) образование глюконолактона и пероксида водорода H2O2 под действием фермента глюкозооксидазы;
2) окисление бесцветного вещества пероксидом водорода в окрашенное зеленое соединение в реакции, катализируемой пероксидазой.
Когда вся имеющаяся в пробе глюкоза израсходована, количество образованного окрашенного вещества можно определить по светопоглощению, которое прямо пропорционально первоначальному содержанию глюкозы.


