Пероксидазы
ПЕРОКСИДАЗЫ (донор: пероксид водорода оксидоредук-тазы), ферменты класса оксидоредуктаз, катализирующие окисление с помощью H2O2 разл. неорг. и орг. в-в по схеме:
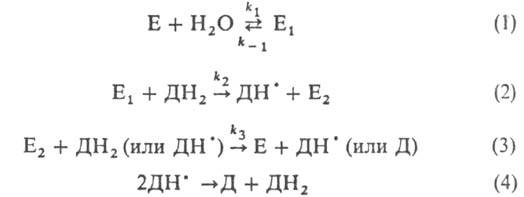
E, E1 и E2- соотв. исходная пероксидаза и ее окисленные формы; ДН2, ДН• и Д-соотв. исходный, полуокисленный и окисленный субстраты; k-константа скорости р-ции.
Р-ция 1 практически необратима (k1/k_1 > 108). Наиб. медленная стадия - р-ция 3. Пероксидазы высокоспецифичны к H2O2 и обычно обладают широкой специфичностью к субстрату (известны пероксидазы, проявляющие высокую специфичность).
Наиб. изучена пероксидаза из корней хрена (мол. м. 40 тыс.), молекула к-рой состоит из одной полипептидной цепи (308 аминокислотных остатков), связанной ковалентно с 8 олиго-сахаридными цепями. Молекула содержит также некова-лентно связанный гем с атомом Fe(III) у E и Fe(IV) у E1 и E2 (у нек-рых пероксидаз гем отсутствует). При рН ниже 3 и выше 12 гем-белковый комплекс разрушается.
Пероксидазы существует в виде неск. форм (изоферментов), состав и соотношение между к-рыми зависит от состояния растения. Для наиб. распространенного изофермента из хрена (пероксидаза С) определена аминокислотная последовательность, на основании к-рой синтезирован ген пероксидаз. Для пероксидазы из этого источника установлена корреляция между окислит.-восстановит, потенциалом субстрата и величиной k2 . Наиб. активные субстраты — п- и о-замещенные фенолы и ароматич. амины, для к-рых fc3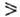 104M-1 с-1.
104M-1 с-1.
Оптим. каталитич. активность пероксидаз из разных источников в р-циях с орг. субстратами при рН 5-7, с неорганическими при рН 4. Ингибиторы пероксидаз -ионы, образующие прочные комплексы с катионом Fe(CN—, N3—, S2— и др.).
Пероксидазы широко распространены в животных и растит. клетках (могут находиться как в связанном с клеточной стенкой состоянии, так и в цитоплазме); они участвуют в фотосинтезе, энергетич. обмене, в трансформации пероксидов и в-в, чужеродных организму. Активность пероксидаз и изоферментный состав значительно изменяются при стрессовых состояниях, ранении, вирусном или микробном инфицировании организма.
Используют пероксидазы в аналит. целях (напр., для определения микроколичеств H2O2, ароматич. аминов, загрязнений в окружающей среде), а также в иммуноферментном анализе. Данные по пероксидазной активности учитывают при селекции растений (чем выше эта активность, тем устойчивее к инфекции растения). Перспективно применение пероксидаз для селективного окисления орг. соединении, а также для глубокой очистки сточных вод от ароматич. соединений.
Лит.: Неорганическая биохимия, пер. с англ., т. 2. M., 1978, с. 434-68; Угарова H. H., Лебедева О. В., "Биохимия", 1978, т. 43, в. 10, с. 1731-40; Андреева В. А., Фермент пероксидаза, M., 1988. H. H. Угарова.
