Пероксиды
Пероксиды, соединения, в которых атомы кислорода связаны и друг с другом и с атомами более электроположительного элемента. Примеры: пероксид водорода Н—О—О—Н, пероксид бария 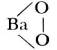 . Термин «пероксиды» введен международной номенклатурой химической; по русской номенклатуре пероксиды называются перекисями. См. Перекисные соединения.
. Термин «пероксиды» введен международной номенклатурой химической; по русской номенклатуре пероксиды называются перекисями. См. Перекисные соединения.
*Подобраны с помощью LLM, верифицированы, но возможны неточности.
Синонимы/примеры:*
Пероксид водорода; Перекись водорода; Диоксид водорода
*подобраны ИИ, возможны неточности
Ещё по теме
Пероксидные соединения в органической химии — типы, свойства и применение
Пероксидные соединения неорганические
Пероксинитраты — свойства и получение
Пероксидаза — функции и роль в биохимии
Пероксидазы — свойства и применение
Перекись водорода — характеристики и применение
Водород пероксид — свойства и применение
Натрия пероксид — свойства и применение
Перекись водорода — свойства и применение
Пероксиацетилнитрат — характеристики и опасность
Супероксид водорода — свойства и разложение

Дополнения к описанию пероксидов: