Водорода пероксид
ВОДОРОДА ПЕРОКСИД (перекись водорода) Н2О2, бесцв. жидкость; т. пл. —0,41 °С (легко переохлаждается), т. кип. 150,2°С; d420 1,450, твердого 1,71 (-20°С); tкрит 457°С, pкрит 21,4 МПа; Сp° [Дж/ (моль*К)]: 89,33, газообразного 42,39;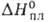 12,50 кДж/ моль,
12,50 кДж/ моль,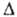 Hoисп 51,60 кДж/моль (25 °С),
Hoисп 51,60 кДж/моль (25 °С),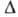 Hoобр газообразного - 135,88 кДж/моль, жидкого - 187,78 кДж/моль; Sо298 [Дж/ (моль*К)]: 109,60, газообразного 234,41;
Hoобр газообразного - 135,88 кДж/моль, жидкого - 187,78 кДж/моль; Sо298 [Дж/ (моль*К)]: 109,60, газообразного 234,41;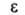 70,7 (25°С); дипольный момент 2,13*10-30 Кл*м (в С6Н6, 25°С);
70,7 (25°С); дипольный момент 2,13*10-30 Кл*м (в С6Н6, 25°С);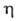 1,245*10-3 Па*с;
1,245*10-3 Па*с;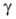 0,0804 Н/м; nD20 1,4077. Кристаллич. решетка тетрагональная (а = 0,406 нм, с = 0,80 нм, z = 4, пространств. группа Р41212). Слабая к-та, рКа 11,6 (в воде, 20 °С). Характеристич. полосы поглощения в ИК-спектре: 370 и 880 см-1, 1390 и 1266 см-1, 3598,7 и 3610,7 см-1 (3400 для жидкого Н2О2). Водорода пероксид смешивается с водой во всех отношениях, образует дигидрат с т. пл. - 52,0 °С. Раств. в спирте, эфире. Образует кристаллич. соль-ваты общей ф-лы R*nH2O2, используемые как твердые носители водорода пероксида, напр. Na2CO3*l,5H2O2, CO(NH2)2*H2O2.
0,0804 Н/м; nD20 1,4077. Кристаллич. решетка тетрагональная (а = 0,406 нм, с = 0,80 нм, z = 4, пространств. группа Р41212). Слабая к-та, рКа 11,6 (в воде, 20 °С). Характеристич. полосы поглощения в ИК-спектре: 370 и 880 см-1, 1390 и 1266 см-1, 3598,7 и 3610,7 см-1 (3400 для жидкого Н2О2). Водорода пероксид смешивается с водой во всех отношениях, образует дигидрат с т. пл. - 52,0 °С. Раств. в спирте, эфире. Образует кристаллич. соль-ваты общей ф-лы R*nH2O2, используемые как твердые носители водорода пероксида, напр. Na2CO3*l,5H2O2, CO(NH2)2*H2O2.
Чистый Н2О2 термически устойчив, при ~20°С разлагается ок. 0,5% в год. В присут. ионов тяжелых металлов, а также под действием света и при нагр. скорость распада резко увеличивается; разложение Н2О2 может происходить со взрывом. Стабильность водных р-ров Н2О2 растет с увеличением концентрации ионов Н3О+ и максимальна при рН 3,5-4,5.
Водорода пероксид обладает как окислительными, так и восстановительными св-вами: окисляет I- до I, SO32- до SO42-, Ti3+ до Ti4+, бензол в фенол, анилин в азоксибензол, эпоксидирует ненасыщенные соед.; восстанавливает Ag2O до Ag, МnО4 до Мn2+, Се4+ до Се3+ и др. Замещением атомов Н в Н2О2 м. б. получены др. пероксидные соединения, напр. пероксиды металлов, диацилпероксиды, диалкилпероксиды.
Основной (свыше 80% мирового произ-ва) пром. способ получения Н2О2 - автоокисление алкилантрагидрохинонов, в первую очередь 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов: 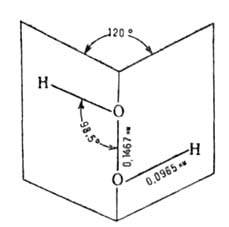
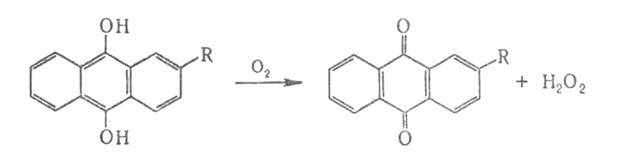
Процесс проводят в смеси С6Н6 с вторичными спиртами. Водорода пероксид экстрагируют водой, растворы Н2О2 концентрируют перегонкой и ректификацией. Образующиеся алкилантрахиноны восстанавливают Н, в присут. Ni или Pt и вновь используют для получения Н2О2. Водорода пероксид получают, кроме того, автоокислением изо-С3Н7ОН [(СН3)2СНОН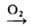 (СН3)2С(ООН)ОН
(СН3)2С(ООН)ОН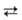 (СН3)2СО + Н2O2] и C6H5NHNHC6H5, а также анодным окислением разб. H2S04:
(СН3)2СО + Н2O2] и C6H5NHNHC6H5, а также анодным окислением разб. H2S04:
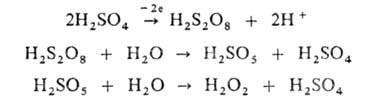
Выпускается Н2О2 в виде 30-90%-ных водных р-ров (30%-ный р-р, содержащий стабилизирующие добавки, наз. пергидролем).
Водорода пероксид применяют: для получения орг. и неорг. пероксидов, пербората и перкарбоната Na; как окислитель в ракетных топливах; при получении эпоксидов, гидрохинона, пирокатехина, этиленгликоля, глицерина, ускорителей вулканизации группы тиурама и др.; для отбеливания масел, жиров, меха, кожи, текстильных материалов, бумаги; для очистки германиевых и кремниевых полупроводниковых материалов (путем перевода нерастворимых в воде примесей в растворимые); при извлечении металлов из руд [напр., окислением UO2 (нерастворимая форма) до UO4 (раств. в воде)]; как дезинфицирующее ср-во для обезвреживания бытовых и индустриальных сточных вод; в медицине; как источник О2 в подводных лодках; Н2О2 входит в состав реактива Фентона (Fe2 + +. Н2О2), к-рый используют как источник своб. радикалов ОН в орг. синтезе.
Конц. водные р-ры Н2О2 взрывоопасны, орг. соед. и их р-ры, содержащие Н2О2, способны к воспламенению и взрыву при ударе. Ниж. КПВ в воздухе 26 мол. %. Вызывает ожоги кожи, слизистых оболочек и дыхат. путей; ПДК 1,4 мг/м3. Для стабилизации техн. Н2О2 в него добавляют пирофосфат или станнат Na; при хранении в алюминиевых емкостях используют ингибитор коррозии - NH4NO3.
Водорода пероксид получен впервые Л. Тенаром в 1818 при действии H2SO4 на ВаО2.
Мировое произ-во ок. 0,5 млн. т/год (1980).
Помимо Н2О2 известны также высшие пероксиды водорода (полиоксиды водорода): Н2О3 и Н2О4 получают конденсацией при — 195°С плазмы тлеющего разряда в системах Н2-О2, а также взаимод. атомов Н с жидким О3; Н2О3 при — 55 °С разлагается до Н2О и О2, Н2О4 при -100°С-до Н2О2 и О2.
Литература
Шамб У., Сеттерфилд Ч., Вентворс Р., Перекись водорода, пер. с англ., М., 1958; Я год о век а я Т. В., Некрасов Л. И., "Ж. фнз. химии", 1977, т. 51, № 10, с. 2434-45; Weigert W. М. [u. a.], "Chemiker-Ztg.", 1975, Bd 99, N 3, S. 101-120; The chemistry of peroxides, ed. S. Patai, 1983, p. 1-96. В.Л. Антоновский.
