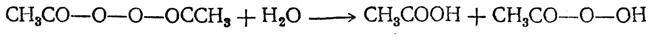Гидроперекиси и перекиси кислот (надкислоты и диацилперекиси)
Гидроперекиси кислот (надкислоты, перкислоты) могут быть получены из карбоновых кислот или их ангидридов окислением концентрированной перекисью водорода в присутствии серной кислоты, неорганическими надкислотами или их солями, например перборатом натрия NaBO3. Кроме того, их можно получать действием метилата натрия на перекиси кислот:
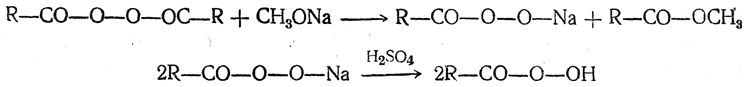
Низшие гидроперекиси кислот представляют собой бесцветные жидкости с удушливым запахом, напоминающим запах озона. В воде они растворимы лучше соответствующих карбоновых кислот.
Надмуравьиная кислота НСОООН нестойка и быстро разрушается. Тем не менее она широко используется в момент образования как мягкий окислитель для превращения олефинов в гликоли.
Надуксусная кислота СН3СОООН (т. пл. 0,1° С) устойчива при комнатной температуре, но взрывает при перегонке даже в вакууме. Она является очень слабой кислотой. При длительном действии воды дает уксусную кислоту и перекись водорода.
Надпропионовая кислота С2Н5СОООН (т. пл. —13,5° С; т. кип. 25° С при 20 мм) и высшие кислоты уже настолько устойчивы, что могут быть перегнаны в вакууме.
При действии хлор ангидридов или ангидридов кислот на перекись водорода (в отсутствие серной кислоты) или перекиси металлов получаются перекиси кислот, или диацилперекиси, например:
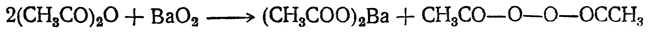
Как и перекись водорода, перекисные соединения кислот являются сильными окислителями.
Перекись ацетила СН3СО—О—О—ОССН3 представляет собой кристаллическое вещество с т. пл. 30° Сит. кип. 63° С (при 21 мм). При нагревании выше температуры кипения сильно взрывает. Реагируя с водой, дает смесь уксусной кислоты и гидроперекиси ацетила: