Серная кислота
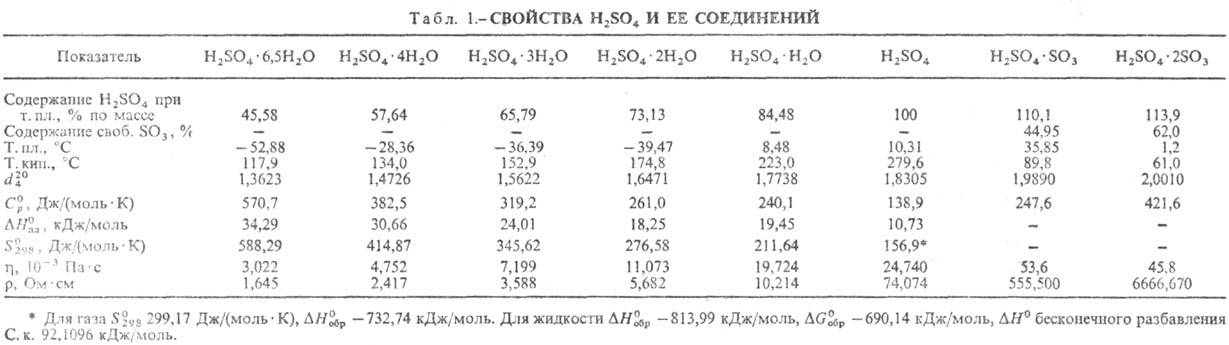
СЕРНАЯ КИСЛОТА H2SO4, мол. м. 98,082; бесцв. маслянистая жидкость без запаха. Очень сильная двухосновная к-та, при 18°С pKa1 - 2,8, K21,2·10-2, pKa2l,92; длины связей в молекуле S=O 0,143 нм, S—ОН 0,154 нм, угол HOSOH 104°, OSO 119°; кипит с разл., образуя азеотропную смесь (98,3% H2SO4 и 1,7% Н2О с т. кип. 338,8 °С; см. также табл. 1). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, 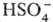 0,18,
0,18, 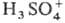 0,14, Н3О+ 0,09, H2S2O7 0,04, HS2O7 0,05. Смешивается с водой и SO3 во всех соотношениях. В водных р-рах серная кислота практически полностью диссоциирует на Н+,
0,14, Н3О+ 0,09, H2S2O7 0,04, HS2O7 0,05. Смешивается с водой и SO3 во всех соотношениях. В водных р-рах серная кислота практически полностью диссоциирует на Н+, 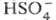 и
и 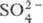 . Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Р-ры SO3 в серной кислоте наз. олеумом, они образуют два соед. H2SO4·SO3 и H2SO4·2SO3. Олеум содержит также пиросерную к-ту, получающуюся по р-ции: Н2SO4 + + SO3:H2S2O7.
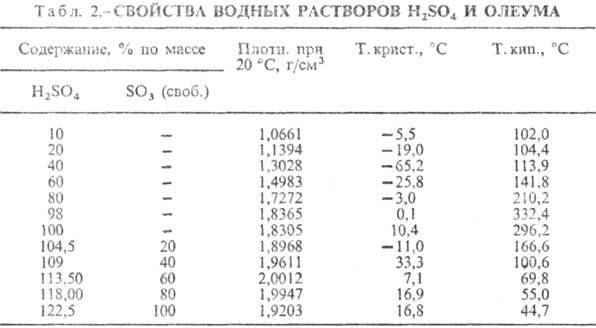
Т-ра кипения водных р-ров серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3% H2SO4 (табл. 2). Т-ра кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных р-ров серной кислоты общее давление пара над р-рами понижается и при содержании 98,3% H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными р-рами серной кислоты и олеума можно вычислить по ур-нию: lgp(Пa) = А — В/Т+ 2,126, величины коэф. А и В зависят от концентрации серной кислоты. Пар над водными р-рами серной кислоты состоит из смеси паров воды, Н2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением т-ры усиливается диссоциация H2SO4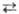 H2О + SO3 — Q, ур-ние температурной зависимости константы равновесия lnКp = 14,74965 - 6,71464ln(298/T) - 8, 10161·104T2-9643,04/T-9,4577·10-3Т+2,19062 x 10-6T2. При нормальном давлении степень диссоциации: 10-5 (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К). Плотность 100%-ной серной кислоты можно определить по ур-нию: d= 1,8517 — — 1,1 · 10-3 t + 2·10-6t2 г/см3. С повышением концентрации р-ров серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
H2О + SO3 — Q, ур-ние температурной зависимости константы равновесия lnКp = 14,74965 - 6,71464ln(298/T) - 8, 10161·104T2-9643,04/T-9,4577·10-3Т+2,19062 x 10-6T2. При нормальном давлении степень диссоциации: 10-5 (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К). Плотность 100%-ной серной кислоты можно определить по ур-нию: d= 1,8517 — — 1,1 · 10-3 t + 2·10-6t2 г/см3. С повышением концентрации р-ров серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении т-ры теплопроводность l уменьшается: l = 0,518 + 0,0016t - (0,25 + + t/1293)·С/100, где С-концентрация серной кислоты, в %. Макс. вязкость имеет олеум H2SO4·SO3, с повышением т-ры h снижается. Электрич. сопротивление серной кислоты минимально при концентрации 30 и 92% H2SO4 и максимально при концентрации 84 и 99,8% H2SO4. Для олеума миним. r при концентрации 10% SO3. С повышением т-ры r серной кислоты увеличивается. Диэлектрич. проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопич. постоянная 6,12, эбулиоскопич. постоянная 5,33; коэф. диффузии пара серной кислоты в воздухе изменяется с изменением т-ры; D = 1,67· 10-5 T3/2 см2/с.
Серная кислота-довольно сильный окислитель, особенно при нагр.; окисляет HI и частично НВг до своб. галогенов, углерод-до СО2, S-до SO2, окисляет мн. металлы (Си, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиб. сильными восстановителями-до S и H2S. Конц. H2SO4 частично восстанавливается Н2, из-за чего не может применяться для его сушки. Разб. H2SO4 взаимод. со всеми металлами, находящимися в электрохим. ряду напряжений левее водорода, с выделением Н2. Окислит. св-ва для разб. H2SO4 нехарактерны. Серная кислота дает два ряда солей: средние-сульфаты и кислые-гидросульфаты (см. Сульфаты неорганические), а также эфиры (см. Сульфаты органические). Известны пероксомоносерная (к-та Каро) H2SO5 и пероксоди-серная H2S2O8 к-ты (см. Сера).
Получение. Сырьем для получения серной кислоты служат: S, сульфи-ды металлов, H2S, отходящие газы теплоэлектростанций, сульфаты Fe, Ca и др. Осн. стадии получения серной кислоты: 1) обжиг сырья с получением SO2; 2) окисление SO2 до SO3 (конверсия); 3) абсорбция SO3. В пром-сти применяют два метода получения серной кислоты, отличающихся способом окисления SO2,-контактный с использованием твердых катализаторов (контактов) и нитрозный-с оксидами азота. Для получения серной кислоты контактным способом на совр. заводах применяют ванадиевые катализаторы, вытеснившие Pt и оксиды Fe. Чистый V2O5 обладает слабой каталитич. активностью, резко возрастающей в присут. солей щелочных металлов, причем наиб. влияние оказывают соли К. Промотирующая роль щелочных металлов обусловлена образованием низкоплавких пиросульфованадатов (3К2S2О7 · V2О5, 2К2S2O7 · V2O5 и K2S2O7·V2O5, разлагающихся соотв. при 315-330, 365-380 и 400-405 °С). Активный компонент в условиях катализа находится в расплавленном состоянии.
Схему окисления SO2 в SO3 можно представить след. образом:
На первой стадии достигается равновесие, вторая стадия медленная и определяет скорость процесса.
Произ-во серной кислоты из серы по методу двойного контактирования и двойной абсорбции (рис. 1) состоит из след. стадий. Воздух после очистки от пыли подается газодувкой в сушильную башню, где он осушается 93-98%-ной серной кислотой до содержания влаги 0,01% по объему. Осушенный воздух поступает в серную печь после предварит. подогрева в одном из теплообменников контактного узла. В печи сжигается сера, подаваемая форсунками: S + О2 : SO2 + + 297,028 кДж. Газ, содержащий 10-14% по объему SO2, охлаждается в котле и после разбавления воздухом до содержания SO2 9-10% по объему при 420 °С поступает в контактный аппарат на первую стадию конверсии, к-рая протекает на трех слоях катализатора (SO2 + V2O2 : : SO3 + 96,296 кДж), после чего газ охлаждается в теплообменниках. Затем газ, содержащий 8,5-9,5% SO3, при 200 °С поступает на первую стадию абсорбции в абсорбер, орошаемый олеумом и 98%-ной серной кислотой: SO3 + Н2 О : Н2 SO4 + + 130,56 кДж. Далее газ проходит очистку от брызг серной кислоты, нагревается до 420 °С и поступает на вторую стадию конверсии, протекающую на двух слоях катализатора. Перед второй стадией абсорбции газ охлаждается в экономайзере и подается в абсорбер второй ступени, орошаемый 98%-ной серной кислотой, и затем после очистки от брызг выбрасывается в атмосферу.
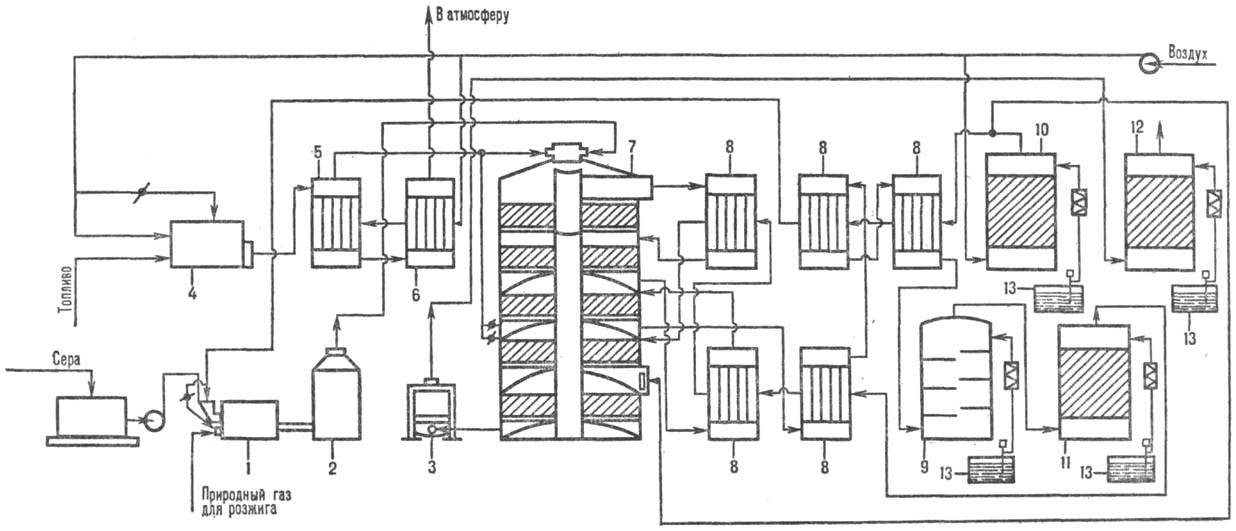
Рис. 1. Схема произ-ва серной к-ты из серы: 1-серная печь; 2-котел-утилизатор; 3 - экономайзер; 4-пусковая топка; 5, 6-теплообменники пусковой топки; 7-контактный аппарат; 8-теплообменники; 9-олеумный абсорбер; 10-сушильная башня; 11 и 12-соотв. первый и второй моногидратные абсорберы; 13-сборники к-ты.
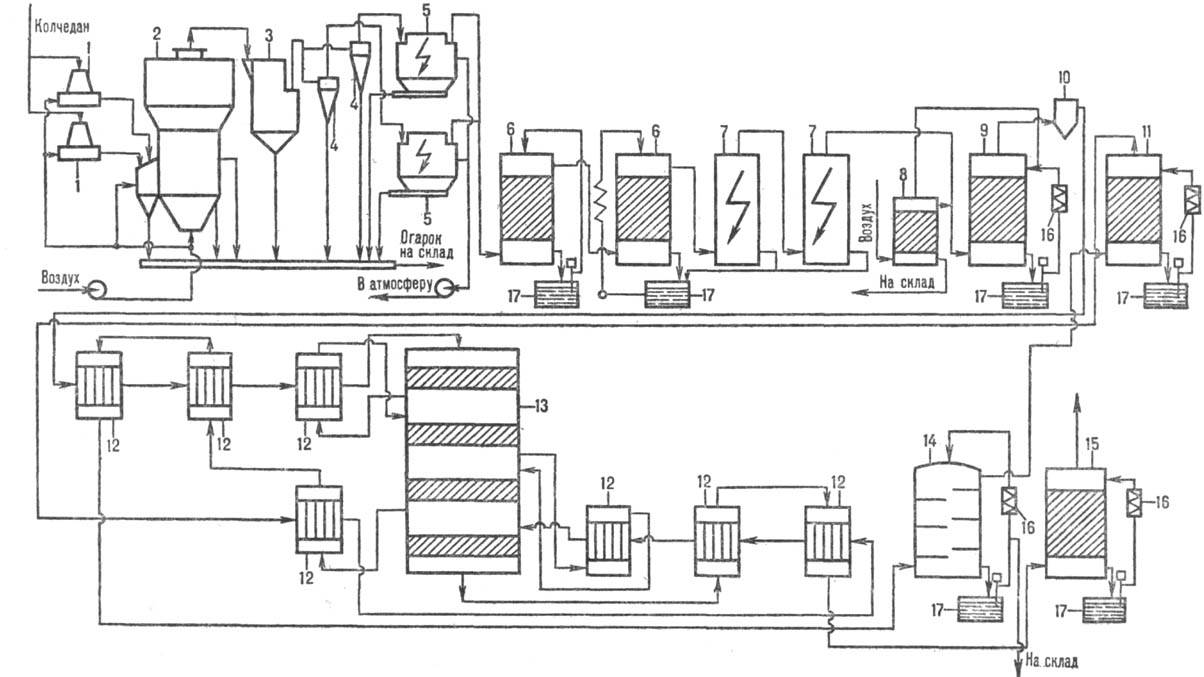
Рис.2. Схема произ-ва серной к-ты из колчедана: 1-тарельчатый питатель; 2-печь; 3-котел-утилизатор; 4-циклоны; 5-электрофильтры; 6-промывные башни; 7-мокрые электрофильтры; 8-отдувочная башня; 9-сушильная башня; 10-брызгоуловитель; 11-первый моногидратный абсорбер; 12-теплообмен-вики; 13 - контактный аппарат; 14-олеумный абсорбер; 15-второй моногидратный абсорбер; 16-холодильники; 17-сборники.
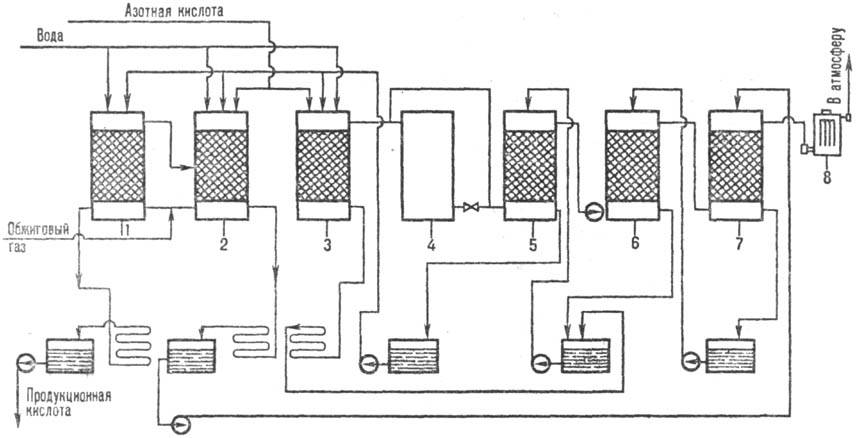
Рис. 3. Схема произ-ва серной к-ты нитроз-ным методом: 1 - денитрац. башня; 2, 3-первая и вторая продукц. башни; 4-окислит. башня; 5, 6, 7-абсорбц. башни; 8 - электрофильтры.
Произ-во серной кислоты из сульфидов металлов (рис. 2) существенно сложнее и состоит из след. операций. Обжиг FeS2 производят в печи кипящего слоя на воздушном дутье: 4FeS2 + 11О2 : 2Fe2 O3 + 8SO2 + 13476 кДж. Обжиговый газ с содержанием SO2 13-14%, имеющий т-ру 900 °С, поступает в котел, где охлаждается до 450 °С. Очистку от пыли осуществляют в циклоне и электрофильтре. Далее газ проходит через две промывные башни, орошаемые 40%-ной и 10%-ной серной кислотой. При этом газ окончательно очищается от пыли, фтора и мышьяка. Для очистки газа от аэрозоля серной кислоты, образующегося в промывных башнях, предусмотрены две ступени мокрых электрофильтров. После осушки в сушильной башне, перед к-рой газ разбавляется до содержания 9% SO 2, его газодувкой подают на первую стадию конверсии (3 слоя катализатора). В теплообменниках газ подогревается до 420 °С благодаря теплу газа, поступающего с первой стадии конверсии. SO2, окисленный на 92-95% в SO3, идет на первую стадию абсорбции в олеумный и моногидратный абсорберы, где освобождается от SO3. Далее газ с содержанием SO2 ~ 0,5% поступает на вторую стадию конверсии, к-рая протекает на одном или двух слоях катализатора. Предварительно газ нагревается в др. группе теплообменников до 420 °С благодаря теплу газов, идущих со второй стадии катализа. После отделения SO3 на второй стадии абсорбции газ выбрасывается в атмосферу.
Степень превращения SO2 в SO3 при контактном способе 99,7%, степень абсорбции SO3 99,97%. Произ-во серной кислоты осуществляют и в одну стадию катализа, при этом степень превращения SO2 в SO3 не превышает 98,5%. Перед выбросом в атмосферу газ очищают от оставшегося SO2 (см. Газов очистка). Производительность совр. установок 1500-3100 т/сут.
Сущность нитрозного метода (рис. 3) состоит в том, что обжиговый газ после охлаждения и очистки от пыли обрабатывают т. наз. нитрозой-серной кислотой, в к-рой раств. оксиды азота. SO2 поглощается нитрозой, а затем окисляется: SO2 + N2O3 + Н2О : Н2SO4 + NO. Образующийся NO плохо раств. в нитрозе и выделяется из нее, а затем частично окисляется кислородом в газовой фазе до NO2. Смесь NO и NO2 вновь поглощается серной кислотой и т.д. Оксиды азота не расходуются в нитрозном процессе и возвращаются в производств. цикл, вследствие неполного поглощения их серной кислотой они частично уносятся отходящими газами. Достоинства нитрозного метода: простота аппаратурного оформления, более низкая себестоимость (на 10-15% ниже контактной), возможность 100%-ной переработки SO2.
Аппаратурное оформление башенного нитрозного процесса несложно: SO2 перерабатывается в 7-8 футерованных башнях с керамич. насадкой, одна из башен (полая) является регулируемым окислит. объемом. Башни имеют сборники к-ты, холодильники, насосы, подающие к-ту в напорные баки над башнями. Перед двумя последними башнями устанавливается хвостовой вентилятор. Для очистки газа от аэрозоля серной кислоты служит электрофильтр. Оксиды азота, необходимые для процесса, получают из HNO3. Для сокращения выброса оксидов азота в атмосферу и 100%-ной переработки SO2 между продукционной и абсорбционной зонами устанавливается безнитрозный цикл переработки SO2 в комбинации с водно-кислотным методом глубокого улавливания оксидов азота. Недостаток нитрозного метода-низкое качество продукции: концентрация серной кислоты 75%, наличие оксидов азота, Fe и др. примесей.
Для уменьшения возможности кристаллизации серной кислоты при перевозке и хранении установлены стандарты на товарные сорта серной кислоты, концентрация к-рых соответствует наиб. низким т-рам кристаллизации. Содержание серной кислоты в техн. сортах (%): башенная (нитрозная) 75, контактная 92,5-98,0, олеум 104,5, высокопроцентный олеум 114,6, аккумуляторная 92-94. Серную кислоту хранят в стальных резервуарах объемом до 5000 м3, их общая емкость на складе рассчитана на десятисуточньш выпуск продукции. Олеум и серную кислоту перевозят в стальных железнодорожных цистернах. Конц. и аккумуляторную серную кислоту перевозят в цистернах из кислотостойкой стали. Цистерны для перевозки олеума покрывают теплоизоляцией и перед заливкой олеум подогревают.
Определяют серную кислоту колориметрически и фотометрически, в виде взвеси BaSO4 - фототурбидиметрически, а также ку-лонометрич. методом.
Применение. Серную кислоту применяют в произ-ве минер. удобрений, как электролит в свинцовых аккумуляторах, для получения разл. минер. к-т и солей, хим. волокон, красителей, дымообразующих в-в и ВВ, в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях пром-сти. Ее используют в пром. орг. синтезе в р-циях дегидратации (получение диэтилового эфира, сложных эфиров), гидратации (этанол из этилена), сульфирования (синтетич. моющие ср-ва и промежут. продукты в произ-ве красителей), алкили-рования (получение изооктана, полиэтиленгликоля, капро-лактама) и др. Самый крупный потребитель серной кислоты-произ-во минер. удобрений. На 1 т Р2О5 фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH4)2SO4-0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по произ-ву минер. удобрений. Мировое произ-во серной кислоты в 1987 достигло 152 млн. т.
Серная кислота и олеум - чрезвычайно агрессивные в-ва, поражают дыхат. пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, нередко-ларингит, трахеит, бронхит и т. д. ПДК аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м3, в атм. воздухе 0,3 мг/м3 (макс. разовая) и 0,1 мг/м3 (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности 2. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов хим. и металлургич. произ-в, содержащих оксиды S, и выпадать в виде кислотных дождей.
Лит.: Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971; Амелин А. Г., Технология серной кислоты, 2 изд., М., 1983; Васильев Б. Т., Отвагина М. И., Технология серной кислоты, М., 1985. Ю.В. Филатов.
