Константа равновесия
КОНСТАНТА РАВНОВЕСИЯ (от лат. constans, род. падеж constantis - постоянный, неизменный), величина, определяющая для данной хим. р-ции соотношение между термодинамич. активностями исходных в-в и продуктов в состоянии хим. равновесия. В общем случае р-ции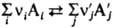 где vi и v'j - стехиометрич. числа исходных в-в Аi (i=1,2,..., q) и продуктов р-ции А'j (j=1, 2, ..., r), активности к-рых соотв.
где vi и v'j - стехиометрич. числа исходных в-в Аi (i=1,2,..., q) и продуктов р-ции А'j (j=1, 2, ..., r), активности к-рых соотв. 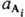 и
и 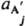 , константа равновесия
, константа равновесия 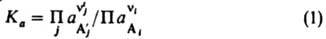
(П - оператор произведения). Это выражение является мат. записью действующих масс закона; оно справедливо для всех состояний хим. равновесия системы независимо от ее начального состава и наличия в ней др. хим. р-ций. Константа равновесия связана со стандартным изменением энергии Гиббса DG° рассматриваемой р-ции при данных т-ре Т и давлении р соотношением: RTlnKa=-DG° (R-газовая постоянная). Зависимости Ка от т-ры и давления выражаются соотношениями:
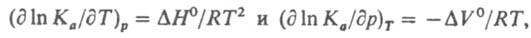
где DH° и DV° - соотв. стандартные изменения энтальпии и объема системы при данной р-ции. Численное значение Ка зависит от способа выбора стандартного состояния для каждого из участвующих в р-ции в-в. Для р-ций в р-рах в качестве стандартного состояния реагентов м.б. приняты чистые жидкости при тех же Т и р; тогда Ка не зависит от природы р-рителя; последний в этом случае определяет значения коэф. активности, связывающих активности в-в с их концентрацией. Для разб. р-ров часто в качестве стандартных состояний реагентов принимают их гипотетич. состояния в предельно разб. р-ре в том же р-рителе, но при единичной концентрации (для рассматриваемой концентрац. шкалы); тогда активность реагента при предельном разбавлении совпадает с его концентрацией, а значение Ка зависит от природы р-рителя. Изменение Ка при перемене р-рителя отражает изменение сольватации - взаимод. молекул реагирующих в-в с молекулами р-рителя. Если в р-ции принимают участие твердые или жидкие в-ва, составляющие индивидуальную фазу, их состояния принято считать стандартными, поэтому их активности равны единице и не входят в выражение для Ка (хотя соответствующие вклады в изменение энергии Гиббса учитываются). Для р-ций в газах в выражение для константы равновесия вместо активностей а входят летучести f реагирующих в-в; константа равновесия в этом случае обозначается Kf. Если реагирующую систему можно считать смесью идеальных газов, летучесть любого из компонентов смеси равна его парциальному давлению pi, что позволяет выражать константу равновесия через pi (обозначается Кр и численно совпадает с Kf) или молярные концентрации сi=pi/RT (обозначается Kf). Эти две константы равновесия связаны соотношением: Кc=Kp/(RT)Dv, где
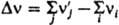 - изменение числа молей газообразных в-в в результате р-ции. Зависимость Kp (и Кс) от т-ры выражается ур-нием Вант-Гоффа dlnKp/dT=DH°/RT2, к-рое наз. также уравнением изобары реакции, поскольку содержит в правой части изобарный тепловой эффект р-ции DH°. Аналогичное ур-ние dlnKc/dT=DU°/RT2 содержит изохорный тепловой эффект р-ции DU°=DH°-RТDv и потому известно как уравнение изохоры реакции. Расчет констант равновесия выполняется с применением таблиц термодинамич. св-в в-в по ур-нию: RTlnКр=TDS0-DH°, где DS° - стандартное изменение энтропии системы при р-ции; возможен также расчет Кр методами статистич. термодинамики, в осн. для р-ций без участия конденсир. фаз. В случае р-ций в р-рах для расчета Ка используют корреляционные соотношения. Определение констант равновесия всех протекающих в системе р-ций и решение ур-ний (1) совместно с ур-ниями материального баланса позволяет отыскать равновесные составы системы при заданных начальных условиях.
- изменение числа молей газообразных в-в в результате р-ции. Зависимость Kp (и Кс) от т-ры выражается ур-нием Вант-Гоффа dlnKp/dT=DH°/RT2, к-рое наз. также уравнением изобары реакции, поскольку содержит в правой части изобарный тепловой эффект р-ции DH°. Аналогичное ур-ние dlnKc/dT=DU°/RT2 содержит изохорный тепловой эффект р-ции DU°=DH°-RТDv и потому известно как уравнение изохоры реакции. Расчет констант равновесия выполняется с применением таблиц термодинамич. св-в в-в по ур-нию: RTlnКр=TDS0-DH°, где DS° - стандартное изменение энтропии системы при р-ции; возможен также расчет Кр методами статистич. термодинамики, в осн. для р-ций без участия конденсир. фаз. В случае р-ций в р-рах для расчета Ка используют корреляционные соотношения. Определение констант равновесия всех протекающих в системе р-ций и решение ур-ний (1) совместно с ур-ниями материального баланса позволяет отыскать равновесные составы системы при заданных начальных условиях. Литература
Киреев В.А., Методы практических расчетов в термодинамике химических реакций, 2 изд., М., 1975; Жоров Ю.М., Термодинамика химических процессов, М., 1985. См. также лит. при ст. Химическая термодинамика.
Ещё по теме
Химическое равновесие — определение и условия
Химическое равновесие — основные понятия и значение
Неравновесная химическая кинетика
Температура в термодинамике и химии
Соответственные состояния закона в химии
Константа в естественных науках — понятие и применение
Термодинамическое равновесие и принцип равновесия Гиббса
Параметры состояния термодинамической системы
Ионный обмен — термодинамические аспекты и влияние ионов
Кинетика ферментативных реакций — основные принципы и уравнения
