5.3.4. Термодинамика ионного обмена
Ионный обмен - обратимый процесс, приводящий, как правило, к установлению термодинамического равновесия. Это обстоятельство позволяет легко регенерировать иониты после их использования. Катиониты регенерируют 0,2-0,5 н. раствором кислоты, аниониты - раствором щелочи, слабоосновные аниониты – раствором соды. При средней степени сшитости ионитов положение ионообменного равновесия определяется в значительной степени природой обменивающихся ионов.
Положение равновесия обмена, например, противоионов типа (1) на ионы типа (2) определяется термодинамической постоянной K:
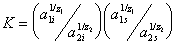 , (1.5.51)
, (1.5.51)
где 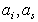 — активности обменивающихся ионов в ионообменнике и в растворе; z1и z2- заряды ионов. Из этого уравнения следует, что склонность ионита к ионному обмену повышается с ростом валентности и растет при переходе от одновалентных ионов кдвух- и трехвалентным ионам. При равных зарядах обменивающихся ионов сродство ионитов к катионам возрастает в соответствии с известными рядами Гофмейстера, например, в рядах Li+ < Na+ < K+ < RЬ+ < Cs+ и Mg2+ < Ca2+ < Sr2+ < Ва2+, к органическим катионам (или анионам) - с растущим числом и размерами органических радикалов в ионе, например, в ряду
— активности обменивающихся ионов в ионообменнике и в растворе; z1и z2- заряды ионов. Из этого уравнения следует, что склонность ионита к ионному обмену повышается с ростом валентности и растет при переходе от одновалентных ионов кдвух- и трехвалентным ионам. При равных зарядах обменивающихся ионов сродство ионитов к катионам возрастает в соответствии с известными рядами Гофмейстера, например, в рядах Li+ < Na+ < K+ < RЬ+ < Cs+ и Mg2+ < Ca2+ < Sr2+ < Ва2+, к органическим катионам (или анионам) - с растущим числом и размерами органических радикалов в ионе, например, в ряду
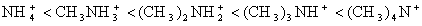 .
.
В приведенных рядах неорганических катионов падает их склонность к гидратации, а в случае органических ионов растет интенсивность дисперсионных взаимодействий с матрицей. Тепловой эффект ионного обмена, не осложненного побочными взаимодействиями, не превышает 4-8 кДж/моль. Поэтому постоянная ионообменного равновесия мало зависит от температуры.
В связи с тем, что активность ионов в ионообменнике ни определить, ни рассчитать по косвенным определениям невозможно, часто при выражении постоянной равновесия ионнного обмена активности ионов в ионообменнике заменяют их массой, тогда уравнение приводят к виду

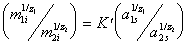 . (1.5.52)
. (1.5.52)
В этой форме уравнение известно как уравнение Никольского.
Если обмениваются ионы одного знака заряда, т.е. при z1 = z2, то
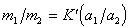 . (1.5.53)
. (1.5.53)
Для разбавленных растворов электролитов, обменивающихся ионами с ионообменником можно активность заменить на концентрацию, тогда
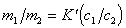 . (1.5.54)
. (1.5.54)
Уравнение (1.5.54) позволяет рассчитать постоянную равновесия ионообменной адсорбции, имеющую большое практическое применение, по результатам определения концентрации ионов в растворе до и после ионного обмена, но следует помнить, что найденная таким образом постоянная не будет строгой термодинамической характеристикой процесса.
Скорость установления равновесия обычно ограничивается диффузией обменивающихся ионов через границу раздела фаз «ионит - раствор» или, чаще, внутри гранул, волокон или мембран ионита.


