Химическое равновесие
ХИМИЧЕСКОЕ РАВНОВЕСИЕ, термодинамич. равновесие в системе, между компонентами к-рой происходят хим. р-ции. Для данной р-ции где Аi - исходные реагенты; Вj - продукты; vi и vj - их стехиометрич. коэффициенты соотв., химическое равновесие достигается при условии:
где Аi - исходные реагенты; Вj - продукты; vi и vj - их стехиометрич. коэффициенты соотв., химическое равновесие достигается при условии:
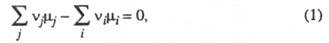
где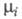 и
и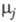 - хим. потенциалы соотв. исходных реагентов и продуктов.
- хим. потенциалы соотв. исходных реагентов и продуктов.
Условие химического равновесия может быть выведено из любого условия термодинамического равновесия, в частности из условия минимума энергии Гиббса системы dGT,p = 0 при постоянных абс. т-ре Т и давлении р.
К условию химического равновесия (1) добавляется требование постоянства т-ры и давления по всему объему системы (в случае гетерогенных р-ций для химического равновесия необходимо, чтобы т-ра и давление были одинаковы во всех фазах системы).
В состоянии химического равновесия система характеризуется константой равновесия Ка , выражающей для р-ций в р-рах соотношение между активностями аАi исходных реагентов и активностями аBj продуктов:

(П - знак произведения). В случае идеальных р-ров вместо активностей компонентов используют их молярные доли xi. Для р-ций в газах активности в-в заменяют летучестями (константа равновесия Kf); если реагирующую систему можно считать идеальной газовой смесью, вместо летучестей возможно применение парциальных давлений компонентов (константа равновесия Кр). Для идеальных систем соотношение (2) наз. действующих масс законом.
 продукты) v становится равной скорости обратного превращения (продукты
продукты) v становится равной скорости обратного превращения (продукты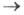 исходные реагенты) v-1. Константа равновесия
исходные реагенты) v-1. Константа равновесия 
где k1 и k-1 - константы скорости прямой и обратной р-ций соотв. Кинетич. определение подчеркивает динамич. характер химического равновесия: при его достижении р-ции в системе не прекращаются. Если в системе происходят несколько связанных между собой хим. р-ций, кинетич. определение химического равновесия (3) выполняется, когда справедлив детального равновесия принцип, т. е. для каждой из р-ций достигается равенство скоростей в прямом и обратном направлениях. Напр., если в системе протекает циклич. превращение
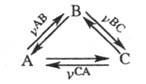
и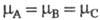 (термодинамич. условие химического равновесия), то обязательно
(термодинамич. условие химического равновесия), то обязательно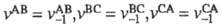 (кинетич. определение).
(кинетич. определение).
Отклонение от химического равновесия сопровождается изменением состава системы и м. б. выражено химическим сродством р-ции А. Устойчивость химического равновесия определяется условием:
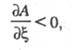
где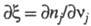 - степень полноты р-ции, равная отношению изменения числа молей nj, любого из участвующих в р-ции в-в к его стехиометрич. коэф. vj.
- степень полноты р-ции, равная отношению изменения числа молей nj, любого из участвующих в р-ции в-в к его стехиометрич. коэф. vj.
Для нек-рых неравновесных систем м. б. использовано понятие локального химического равновесия, к-рое устанавливается в малом объеме системы и соответствует локальным значениям т-ры, давления, хим. потенциалов компонентов.
Важной практич. задачей является термодинамич. расчет химического равновесия, т. е. определение равновесных составов системы. В совр. компьютерных программах такой расчет, как правило, выполняется путем прямой минимизации энергии Гиббса системы без использования констант равновесия. Для идеальных систем результатом расчетов являются концентрации хим. в-в в состоянии равновесия, для реальных систем мат. определение концентрации требует дополнительно знания коэф. активности (или летучести).
Лит. см. при ст. Химическая термодинамика.
М. В. Коробов.
