Активность термодинамическая
АКТИВНОСТЬ термодинамическая, величина, позволяющая представлять в удобной для практич. использования форме концентрац. зависимость хим. потенциалов компонентов реального р-ра. С помощью этой величины можно применять к реальному р-ру термодинамич. соотношения, относящиеся к идеальному р-ру, если заменить в них концентрации активностями. Отношение активности компонента к его концентрации наз. коэф. активности.
Хим. потенциал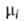 и активность а,- i-того компонента р-ра по определению связаны соотношением:
и активность а,- i-того компонента р-ра по определению связаны соотношением: 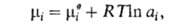
где R-газовая постоянная, T - т-ра,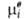 -хим. потенциал компонента в определенным образом выбранном стандартном состоянии. Значения
-хим. потенциал компонента в определенным образом выбранном стандартном состоянии. Значения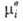 зависят только от T и давления р; ai - ф-ция Т, р и состава р-ра. Т. обр., введение понятия активности позволяет разделить выражение для хим. потенциала на две части: постоянную при данных Т и р
зависят только от T и давления р; ai - ф-ция Т, р и состава р-ра. Т. обр., введение понятия активности позволяет разделить выражение для хим. потенциала на две части: постоянную при данных Т и р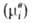 и зависящую от состава (RTlnai). Это разделение условно, поскольку численное значение ai зависит от выбора стандартного состояния. В стандартном состоянии ai = 1.
и зависящую от состава (RTlnai). Это разделение условно, поскольку численное значение ai зависит от выбора стандартного состояния. В стандартном состоянии ai = 1.
Для компонентов жидких р-ров неэлектролитов чаще всего в кач-ве стандартного выбирают состояние чистой жидкости при т-ре и давлении р-ра с хим. потенциалом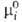 (Т, р). Тогда
(Т, р). Тогда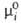 =
=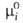 при мольной доле Ni = 1, активность ai и коэф. активности
при мольной доле Ni = 1, активность ai и коэф. активности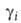 =ai/Ni равны единице. В р-ре
=ai/Ni равны единице. В р-ре 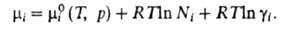
Если р-р ведет себя как идеальный, то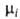 ид =
ид =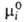 + RT1nNi. Знак разности
+ RT1nNi. Знак разности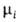 —
—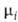 нд = RT\n
нд = RT\n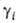 определяет знак отклонения поведения реального р-ра от идеального: при
определяет знак отклонения поведения реального р-ра от идеального: при
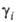 > 1 отклонение от идеальности положительно, при
> 1 отклонение от идеальности положительно, при
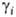 < 1 - отрицательно. Выбор чистых в-в в качестве стандартных состояний для всех компонентов р-ра наз. симметричной нормировкой активностей; ее применяют в тех случаях, когда все компоненты р-ра рассматриваются как равноправные.
< 1 - отрицательно. Выбор чистых в-в в качестве стандартных состояний для всех компонентов р-ра наз. симметричной нормировкой активностей; ее применяют в тех случаях, когда все компоненты р-ра рассматриваются как равноправные.
При т. наз. несимметричной нормировке активностей стандартным состоянием для р-рителя (компонент 1) служит чистая жидкость 1, как и при симметричной нормировке,
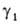 = 1 при Ni = 1. Для растворенного в-ва (компонент 2) принимают, что его активность совпадает с концентрацией и коэф. активности равен единице в предельно разб. р-ре. Иначе говоря, стандартное состояние для этого компонента выбирают т. обр., чтобы
= 1 при Ni = 1. Для растворенного в-ва (компонент 2) принимают, что его активность совпадает с концентрацией и коэф. активности равен единице в предельно разб. р-ре. Иначе говоря, стандартное состояние для этого компонента выбирают т. обр., чтобы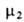 было равно его хим. потенциалу
было равно его хим. потенциалу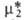 в гипотетич. р-ре единичной концентрации, в к-ром коэф. активности равен единице.
в гипотетич. р-ре единичной концентрации, в к-ром коэф. активности равен единице.
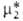 определяют линейной экстраполяцией к единичной концентрации зависимости типа
определяют линейной экстраполяцией к единичной концентрации зависимости типа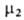 =
=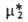 + RTlnN2, к-рая отвечает Генри закону и выполняется лишь при достаточно малых N2. В зависимости от способа выражения концентрации (мольная доля N2, молярность с, моляльность m) стандартный хим. потенциал растворенного в-ва принимает разл. значения; соотв. и активность растворенного в-ва имеет разл. значения:
+ RTlnN2, к-рая отвечает Генри закону и выполняется лишь при достаточно малых N2. В зависимости от способа выражения концентрации (мольная доля N2, молярность с, моляльность m) стандартный хим. потенциал растворенного в-ва принимает разл. значения; соотв. и активность растворенного в-ва имеет разл. значения: 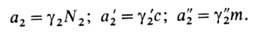
Для р-ров электролитов применяют, как правило, несимметричную нормировку активностей компонентов, но с учетом элек-тролитич. диссоциации. Активность сильного электролита, диссоциирующего на v1 катионов и v2 анионов в р-ре моляльности т, представляют соотношением: a = v1vlv2v2(m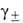 )v, где v = = v1 + v2 и
)v, где v = = v1 + v2 и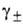 -т. наз. средний ионный коэф. активности;
-т. наз. средний ионный коэф. активности;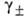 -> 1 при m->0. Аналогично м.б. записана активность и при др. способах выражения концентрации.
-> 1 при m->0. Аналогично м.б. записана активность и при др. способах выражения концентрации.
Активности всех компонентов р-ра связаны между собой Гиббса-Дюгема уравнением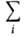 Nidlnai, = 0 (при постоянных Т и р).
Nidlnai, = 0 (при постоянных Т и р).
Это позволяет рассчитывать активность одного из компонентов по данным о концентрац. зависимости всех остальных, а также проверять найденные к.-л. образом значения активностей всех компонентов на их термодинамич. согласованность.
Эксперим. определение активностей компонентов р-ра возможно разл. методами, напр. криоскопией, осмометриеп. Активность летучего компонента обычно определяют по измерениям давления пара, учитывая связь активности с летучестью-, если fi и f 0i -летучести i-того компонента в р-ре и в стандартном состоянии соотв., то ai -fi/f0i. Для системы, в к-рой пар ведет себя как идеальный, ai- = pi/p0i, где р,-парциальное давление компонента над р-ром, р,-- давление пара чистой жидкости.
Характер концентрац. зависимости активности в-ва в том или ином р-ре определяется особенностями межмолекулярных взаимодействий в нем. Теоретич. расчет активностей возможен методами статистич. термодинамики; для практич. расчетов широко используют приближенные модели, напр., регулярного р-ра, атермич. р-ра, групповые модели (см. Растворы неэлектролитов). Для сильных электролитов активность в первом приближении описывается теорией Дебая - Хюккеля (см. Растворы электролитов). Определение активностей и коэф. активности в-в важно при расчетах фазовых и хим. равновесий. Так, общее условие фазового равновесия, заключающееся в равенстве хим. потенциалов данного компонента в каждой из фаз, отвечает условию равенства активностей этого компонента, если они определены по отношению к одному и тому же стандартному состоянию.
Понятия активности и коэф. активности введены Г. Льюисом в 1907.
Литература
Карапетьянц М.Х., Химическая термодинамика, 3 изд., М., 1975; Робинсон Р., Стоке Р., Растворы электролитов, пер. с англ., М„ 1963; Термодинамика разбавленных растворов неэлектролитов, Л., 1982.
