Произведение активностей
ПРОИЗВЕДЕНИЕ АКТИВНОСТЕЙ (ПА), произведение термодинамич. активностей ионов в насыщ. р-ре электролита (соль, гидроксид и т. п.) в данном р-рителе. Растворение твердого в-ва AkBl с образованием ионов Az+ и Вz-записывается как р-ция: AkBl(тв)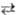 kAz+ (р-р) + lВz- (р-р). Согласно действующих масс закону, константа равновесия
kAz+ (р-р) + lВz- (р-р). Согласно действующих масс закону, константа равновесия
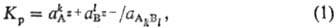
где аАz+, аBz-, аАkBl - активности катионов, анионов и растворенного в-ва соответственно. Т. к. в насыщ. р-рс аАkBl =1. Произведение активностей для ионов
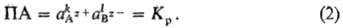
Произведение активностей зависит от т-ры и природы р-рителя, а при фиксир. т-ре в данном р-рителе произведение активностей для каждой соли-пост. величина, характеризующая ее растворимость. Если в р-ре произведение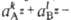 > ПА, твердое соед. АkВl выпадает в осадок, если же
> ПА, твердое соед. АkВl выпадает в осадок, если же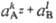 - < ПА, в-во АkВl переходит в р-р. Если выполняется условие (1), р-р и твердое в-во находятся В равновесии.
- < ПА, в-во АkВl переходит в р-р. Если выполняется условие (1), р-р и твердое в-во находятся В равновесии.
В аиалит. химии вместо строгого термодинамич. понятия ПА используется произведение растворимости (ПР), равное произведению молярных концентраций ионов [Az+]k и [Вz-]l в р-ре соли АkВl. ПР связано с ПА через коэф. активности 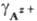 и
и 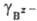
ПА =b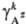 +
+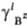 - [Аz+]k[Вz-]l =
- [Аz+]k[Вz-]l =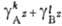 - ПР.
- ПР.
В реальном р-ре ПР, в отличие от ПА, не является пост. величиной: для данного р-рителя при пост. т-ре (т.е. при ПА = const) присутствие в р-ре других растворенных в-в, помимо АkВl , или изменение концентраций ионов Az+ и Вz-приводит к изменению коэф. активности и, следовательно, к изменению ПР. В разб. р-рах электролитов, согласно Девая-Хюккеля теории, коэф. активности связаны с ионной силой р-ра I (напр.,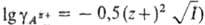 , что позволяет переходить от значений ПА к значениям ПР. На практике обычно считают р-ры идеальными, т. е. принимают ПА = = ПР = const ПР связано с р-римостью S (обычно измеряемой в моль/л) соотношением:
, что позволяет переходить от значений ПА к значениям ПР. На практике обычно считают р-ры идеальными, т. е. принимают ПА = = ПР = const ПР связано с р-римостью S (обычно измеряемой в моль/л) соотношением:
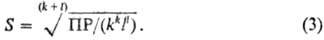
Это соотношение позволяет использовать значение ПР для подбора условий растворения и осаждения в-в. Важно учитывать, что условие ПР = [Аz+]k[Вz-]l = const может выполняться при разл. значениях каждой из концентраций [Аz+] и [Вz-]. Для осаждения соли АkВl из ненасыщ. р-ра обычно добавляют в р-р соль, имеющую с АkВl общий катион или анион, напр. AD или СВ. При этом концентрация ионов Аz+ (или Вz-) в р-ре возрастает, произведение концентраций [Az+]k[Bz-]l превышает ПР и начинается выпадение в осадок АkВl. Наоборот, полный переход АkВl в р-р достигается связыванием одного из ионов (Аz+ или Bz-) в недиссоциируемый комплекс в р-ре, что приводит к снижению концентрации этого иона и выполнению условия [Az+]k[Bz-]l< ПР. Третий способ регулирования р-римости - изменение ионной силы р-ра (т. наз. солевой эффект), когда к р-ру добавляется электролит CD, не имеющий общих ионов с АkВl Это приводит к росту ионной силы, уменьшению g и, следовательно, увеличению р-римости.
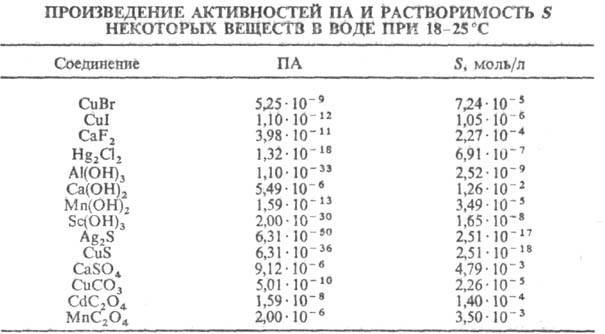
В таблице приведены значения ПА и р-римости S нек-рых в-в в воде при 18-25 °С; стандартное состояние для определения активностей ионов-р-р единичной концентрации (1 моль/л).
Лит.: Лурье Ю. Ю., Справочник по аналитической химии, М., 1979.
М. В. Коробов.
