Действующих масс закон
ДЕЙСТВУЮЩИХ МАСС ЗАКОН: при установившемся хим. равновесии между реагентами и продуктами р-ции выполняется равенство 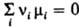 , где mi - хим. потенциал i-го компонента системы, ni - eгo стехиометрич. коэф. (для реагентов он отрицательный, для продуктов р-ции - положительный). Если реагирующие в-ва и продукты р-ции можно рассматривать как идеальные газы, mi выражается через парциальное давление pi:
, где mi - хим. потенциал i-го компонента системы, ni - eгo стехиометрич. коэф. (для реагентов он отрицательный, для продуктов р-ции - положительный). Если реагирующие в-ва и продукты р-ции можно рассматривать как идеальные газы, mi выражается через парциальное давление pi:
mi = mi0 (T) + RT ln pi,
где R - газовая постоянная, Т - т-ра, mi0 (T) - не зависящая от давления составляющая mi. С помощью этого соотношения действующих масс закон можно выразить равенством:
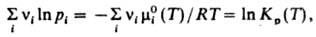
где Кр(Т)- константа равновесия р-ции. Часто левую часть этого равенства записывают в виде произведения: 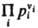 = Кр(Т). Поскольку для идеальных газов pi = сiRТ, где сi - молярная концентрация i-го в-ва, справедливо след. выражение действующих масс закона:
= Кр(Т). Поскольку для идеальных газов pi = сiRТ, где сi - молярная концентрация i-го в-ва, справедливо след. выражение действующих масс закона: 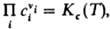 , т. е. действующих масс закон выражает взаимосвязь концентраций компонентов системы при хим. равновесии. Константы равновесия р-ции Кр(Т)и Кc(Т)связаны соотношением:
, т. е. действующих масс закон выражает взаимосвязь концентраций компонентов системы при хим. равновесии. Константы равновесия р-ции Кр(Т)и Кc(Т)связаны соотношением:
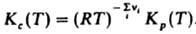
Для реальных газов хим. потенциал выражают через летучести fi компонентов и действующих масс закон записывают в виде: 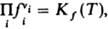 численные значения констант равновесия Kf(T)и Кр(Т)совпадают.
численные значения констант равновесия Kf(T)и Кр(Т)совпадают.
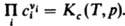 При невысоких давлениях зависимостью К от р обычно пренебрегают. В общем случае для р-ций в р-рах действующих масс закон выражают через активности аi компонентов:
При невысоких давлениях зависимостью К от р обычно пренебрегают. В общем случае для р-ций в р-рах действующих масс закон выражают через активности аi компонентов: 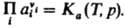 Константа равновесия Ка связана со стандартными хим. потенциалами в-в mi0(Т, р) соотношением:
Константа равновесия Ка связана со стандартными хим. потенциалами в-в mi0(Т, р) соотношением: 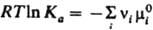 , где mi0 - хим. потенциал i-го в-ва при ai = 1. В хим. кинетике действующих масс закон выражает скорость v р-ции через концентрации реагентов. Для простой р-ции nAA + nBB : продукты, где А и В - реагирующие в-ва, nA и nВ - их стехиометрич. коэф., v = K[А]nA[В]nВ, К-константа скорости р-ции, не зависящая от концентраций реагентов [А] и [В]. Для сложных р-ций действующих масс закон в общем случае не справедлив, однако он нередко выполняется, если такая р-ция имеет одну или неск. лимитирующих стадий. В этом случае, однако, значения nA и nВ в выражениях для скорости р-ции и в стехиометрич. ур-нии р-ции часто различны. Если р-ция протекает обратимо с константами скорости k1 и k_1, напр.:
, где mi0 - хим. потенциал i-го в-ва при ai = 1. В хим. кинетике действующих масс закон выражает скорость v р-ции через концентрации реагентов. Для простой р-ции nAA + nBB : продукты, где А и В - реагирующие в-ва, nA и nВ - их стехиометрич. коэф., v = K[А]nA[В]nВ, К-константа скорости р-ции, не зависящая от концентраций реагентов [А] и [В]. Для сложных р-ций действующих масс закон в общем случае не справедлив, однако он нередко выполняется, если такая р-ция имеет одну или неск. лимитирующих стадий. В этом случае, однако, значения nA и nВ в выражениях для скорости р-ции и в стехиометрич. ур-нии р-ции часто различны. Если р-ция протекает обратимо с константами скорости k1 и k_1, напр.: 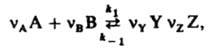
где Y и Z - продукты, nY и nZ - их стехиометрич. коэф., то в условиях равновесия скорости прямой и обратной р-ций равны:
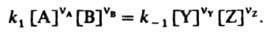
Отсюда следует, что
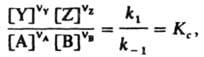
где Кс - константа равновесия р-ции. Действующих масс закон широко используется для расчета равновесных концентраций продуктов р-ции; он позволяет также предсказать направление, в к-ром смещается хим. равновесие при изменении условий протекания р-ции. Для необратимых р-ций действующих масс закон позволяет рассчитать скорость р-ции при любых концентрациях реагентов, если известна константа скорости р-ции. Действующих масс закон был установлен К. Гульдбергом и П. Вааге в 1864-67; его строгий термодинамич. вывод получен Дж. Гиббсом в 1875-78. Е.Т. Денисов.
