Порядок реакции
ПОРЯДОК РЕАКЦИИ по данному в-ву, показатель степени при концентрации этого в-ва в кинетич.. ур-нии р-ции. Согласно действующих масс закону, скорость у простой (одностадийной) р-ции между в-вами А и В типа nАА + nBB : продукты равна:
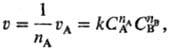
где uА-скорость расходования реагента А, СА и Св-концентрации реагентов А и В, k - константа скорости р-ции, nА и nв-порядки реакции по реагентам А и В соотв., п = nА + nв-общий порядок реакции (nА и nв- частные порядки реакции). Для гомог. р-ции порядок реакции по данному в-ву представляет собой стехиометрич. коэф. этого в-ва в ур-нии р-ции. Напр., в р-ции 2NO + С12 : 2NOC1 порядок реакции по NO равен 2, порядок реакции по С12 равен 1, а общий порядок реакции равен 3. Для простых р-ций порядок реакции всегда целое число (1, 2 или 3).
Для сложных р-ций порядки реакции редко совпадают с суммой стехиометрич. коэф., он м. б. числом переменным, дробным и даже отрицательным. Напр., для параллельных р-ций типа
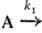 продукты;
продукты;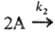 продукты (k1 и k2- константы скорости для соответствующих стадий) суммарная скорость расходования А составляет uА = k1СА +
продукты (k1 и k2- константы скорости для соответствующих стадий) суммарная скорость расходования А составляет uА = k1СА +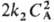 и порядок реакции меняется по мере увеличения СА от 1 (uA — k1 СА) до 2 (uА =
и порядок реакции меняется по мере увеличения СА от 1 (uA — k1 СА) до 2 (uА =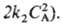 Для цепной р-ции типа+
Для цепной р-ции типа+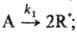
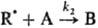 +
+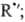
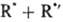
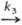 D в условиях, когда k1CA
D в условиях, когда k1CA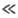
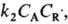 скорость расходования А составляет
скорость расходования А составляет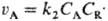 , т. к.
, т. к. 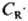 = (k1 CA/k3)1/2, то
= (k1 CA/k3)1/2, то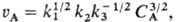 так что nА = 3/2. Для мономолекулярного превращения А в присут. В, образующего с А неактивный комплекс (А
так что nА = 3/2. Для мономолекулярного превращения А в присут. В, образующего с А неактивный комплекс (А продукты; А + В
продукты; А + В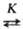 D), скорость р-ции
D), скорость р-ции 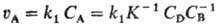 (К- константа равновесия). Если равновесие сдвинуто вправо (CD
(К- константа равновесия). Если равновесие сдвинуто вправо (CD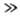 CA), порядок реакции по В равен -1.
CA), порядок реакции по В равен -1.
Если зависимость скорости расходования исходного реагента или скорости накопления продукта сложной р-ции от соответствующих концентраций не описывается степенной ф-цией, говорить о порядке реакции по данному реагенту (продукту) не имеет смысла. Напр., скорость превращения субстрата S.
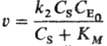
в присут. фермента Е составляет(KM-константа Михаэлиса) и зависит от начальнойконцентраций фермента 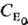 в первой степени, а зависимость от концентрации субстрата Cs не степенная. Такая р-ция имеет первый порядок по ферменту, говорить же о порядке реакции по субстрату не имеет смысла.
в первой степени, а зависимость от концентрации субстрата Cs не степенная. Такая р-ция имеет первый порядок по ферменту, говорить же о порядке реакции по субстрату не имеет смысла.
Существует ряд эмпирич. методов определения порядка реакции 1) Проводят серию опытов с переменной концентрацией реагента А, определяют начальную скорость его расходования uА и находят порядок реакции как отношение: nА = dln uA/dln CA. 2) Все реагенты, кроме А, берут в избытке, скорость расходования A ut измеряют в разные моменты времени t, порядок реакции находят как отношение: nА = dln ut/dln CA. 3) Измеряют время t1/p превращения А на 1/p-ю часть, когда все реагенты, кроме А, взяты в избытке. Это время не зависит от начальной концентрации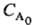 в-ва А, если nА = 1; оно обратно пропорционально
в-ва А, если nА = 1; оно обратно пропорционально 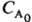 при nА = 2 и обратно пропорционально
при nА = 2 и обратно пропорционально 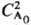 при nА = 3. Так, для превращения на 50% t1/2 = k-1 ln 2 при nА = 1; tl/2 = (k
при nА = 3. Так, для превращения на 50% t1/2 = k-1 ln 2 при nА = 1; tl/2 = (k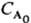 )-1 при nА = 2 и t1/2 = 3/2k при nА = 3. Здесь k-константа скорости р-ции, если
)-1 при nА = 2 и t1/2 = 3/2k при nА = 3. Здесь k-константа скорости р-ции, если 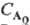 в р-ции участвует только один реагент А; если же А реагирует с В, то k равна константе скорости, умноженной на начальную концентрацию В. В общем случае для п — 1 t1/p = k-1ln[p/(p-l)], a для n.1 t1/р={[p/p-1]n-1-— 1}
в р-ции участвует только один реагент А; если же А реагирует с В, то k равна константе скорости, умноженной на начальную концентрацию В. В общем случае для п — 1 t1/p = k-1ln[p/(p-l)], a для n.1 t1/р={[p/p-1]n-1-— 1}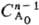 ·(п — 1)k. 4) Следят за расходованием А и определяют порядок реакции по кинетич. кривой (см. Кинетическое уравнение). Если nА = 1, то А расходуется по экспоненц. закону и uА = e-kt. Если я = 2, то кинетич. кривая описывается ф-лой:
·(п — 1)k. 4) Следят за расходованием А и определяют порядок реакции по кинетич. кривой (см. Кинетическое уравнение). Если nА = 1, то А расходуется по экспоненц. закону и uА = e-kt. Если я = 2, то кинетич. кривая описывается ф-лой: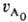 uА =
uА =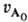 (1 + 2k
(1 + 2k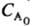 t)-2. По совпадению эксперим. данных с одной из этих ф-л определяют nА .
t)-2. По совпадению эксперим. данных с одной из этих ф-л определяют nА .
Если продукты р-ции влияют на ее протекание, напр. при автокатализе, кинетич. ур-ние становится приближенным. В этих случаях наиб. надежным является 1-й метод определения порядка реакции. Общий порядок реакции можно определить любым из перечисл. методов, проводя р-цию со стехиометрич. смесью реагентов.
Лит. см. при ст. Кинетика химическая. Е. Т. Денисов.
