Фазовое равновесие
ФАЗОВОЕ РАВНОВЕСИЕ, сосуществование термодинамически равновесных фаз гетерогенной системы. Является одним из основных случаев термодинамического равновесия и включает в себя условия равенства т-ры всех частей системы (термич. равновесие), равенства давления во всем объеме системы (мех. равновесие) и равенство хим. потенциалов каждого компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f, находящихся одновременно в равновесии, связано с числом компонентов k, числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние т-ры и давления, n = 2), и числом термодинамич. степеней свободы v ур-нием: v = k + 2 - f (см. Фаз правило).
В общем виде условие фазового равновесия, согласно принципу равновесия Гиббса, сводится к максимуму энтропии S системы при постоянстве внутр. энергии U, общего объема V и числа молей каждого компонента ni-. Этот принцип можно выразить также как условие минимума любого из термодинамич. потенциалов: внутр. энергии U, энтальпии H, энергии Гиббса G, энергии Гельмгольца А при условии постоянства соответствующих параметров состояния, включая число молей каждого компонента.
Фазовые равновесия могут быть стабильными и метастабильными. Те и другие являются локально устойчивыми, т. е. устойчивыми по отношению к малым возмущениям параметров состояния -т-ры, давления, состава (концентраций компонентов). Мета-стабильные фазовые равновесия отличаются тем, что они неустойчивы к нек-рым конечным изменениям этих параметров, ведущим, в частности, к переходу к другим фазам. Напр., пересыщенный р-р или переохлажденный расплав неустойчивы по отношению к кристаллич. фазе. Поскольку метастабильное состояние системы локально устойчиво, переход к стабильному состоянию требует преодоления нек-рого активационного барьера и протекания процесса зародышеобразования (см. Зарождение новой фазы).
Следует отметить нек-рые особенности метастабильных фаз: при одной и той же т-ре давление пара выше над метастабильной фазой, чем над стабильной; при одном и том же давлении т-ра плавления метастабильной фазы ниже, чем стабильной; растворимость метастабильной фазы при постоянных давлении и т-ре выше, чем стабильной. Последнее справедливо как для жидких, так и для твердых р-ров.
Критерий достижения фазового равновесия. Наиб. общий критерий достижения фазового равновесия - сходимость значений CB-B системы при их измерении, если подходить к состоянию фазового равновесия сверху (со стороны более высоких т-р) и снизу (со стороны низких т-р). Достижение фазового равновесия или хотя бы приближение к нему - важнейший вопрос при изучении диаграмм состояния, В т. ч. диаграмм растворимости, диаграмм плавкости, диаграмм давления пара, а также в физико-химическом анализе. При исследовании р-римости для достижения фазового равновесия применяют длительную (от неск. часов до неск. месяцев) выдержку образца с перемешиванием в термостате. В случае образования в системе твердых р-ров рекомендуется подход к равновесию сверху, от более высоких т-р, сочетающий быстрое охлаждение с целью получения мелких кристаллов и интенсивное перемешивание. При исследовании систем методом термического анализа обычно используют образцы, полученные сплавлением компонентов с последующим медленным охлаждением. В случае образования в системе твердых р-ров и инконгруэнтно плавящихся фаз, а также фаз, разлагающихся в твердом состоянии, требуется проведение предварит. отжига образца при фиксированной т-ре - от неск. часов до неск. месяцев. Для ускорения отжига сплавленных образцов рекомендуется предварит. быстрое охлаждение расплава.
При изучении твердых тел, состоящих из тугоплавких или разлагающихся при высоких т-рах компонентов, применяют такие методы подготовки образцов, как прессование таблеток смесей перед отжигом и промежут. перетирание смесей при отжиге, отжиг смесей солей или гелей, осажденных из водных или других р-ров и т. п.
Типы фазовых равновесий. В однокомпонентной системе (при наличии полиморфных превращений) возможны 4 вида двухфазных равновесий: жидкость - пар, кристалл - пар, кристалл - жидкость и кристалл - кристалл; 4 вида трехфазных равновесий: кристалл - жидкость - пар, кристалл - кристалл - жидкость, кристалл - кристалл - пар и кристалл - кристалл - кристалл; при этом не учитывается возможность образования жидких кристаллов. В двойных системах (компоненты А и В) возможны те же виды двухфазных равновесий, но число возможных видов трехфазных равновесий достигает 26 вследствие того, что играет роль не только природа сосуществующих фаз (их агрегатное состояние), но и взаимное расположение фазовых полей на диаграмме состояния в координатах т-ра -состав (давление предполагается постоянным). Все эти фазовые равновесия делятся на два типа: эвтектич. фазовые равновесия, при к-рых из трех одновременно участвующих в равновесии фаз при понижении т-ры одна испытывает превращение, а две другие при этом образуются, и перитектич. фазовые равновесия, когда две фазы взаимодействуют (превращаются), при этом образуется третья фаза. В простейшем случае, если на основе компонентов А и В возможно образование жидкого р-ра L и двух твердых р-ров a и b, звтектич. и перитектич. Фазовое равновесие можно записать соотв. в виде р-ций:
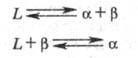
Поскольку в двойной системе состояние трехфазного равновесия является нонвариантным, эвтектич. и перитектич. р-ции происходят при постоянной т-ре, называемой соотв. эвтектической или перитектической, т. е. на диаграмме состояния этим равновесиям отвечают горизонтали.
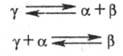
В случае, если в определенной области т-р и составов все три равновесно сосуществующие фазы являются твердыми (у одного из компонентов существуют полиморфные модификации с образованием твердого р-ра g), возможны трехфазные равновесия, наз. эвтектоидными и перитектоид-ными. Их можно представить соотв. р-циями, аналогично эвтектич. и перитектич. фазовым равновесиям:
При наличии в нек-ром температурно-концентрационном интервале двух жидких фаз L1 и L2 и одной твердой (напр., а) возможны трехфазные равновесия, наз. монотектиче-ское и синтектическое:
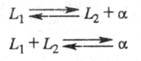
Нек-рые виды трехфазных равновесий, напр. те, при к-рых образуется жидкость в результате взаимод. двух кристаллич. фаз при понижении т-ры, теоретически возможны, но реально, по-видимому, не наблюдаются. При переходе к тройным и более сложным системам число видов многофазных фазовых равновесий возрастает еще больше (см. Тройная точка).
Распределение компонентов между фазами системы при фазовом равновесии описывается законом распределения, устанавливающим, что отношение термодинамич. активностей примеси в двух фазах при фазовом равновесии является постоянной величиной. В первом приближении активности компонентов можно заменить их концентрациями. Одним из условий выполнимости закона распределения в-ва между фазами является одинаковость мол. состояния растворенного в-ва в обеих фазах, т. е. отсутствие ассоциации молекул. Замена активностей на концентрации допустима, если коэф. активности компонента в обеих фазах не зависят от концентрации, т. е. для идеальных р-ров (это условие обычно выполняется для очень разб. р-ров, в случае микроконцентраций). Отношение активностей компонентов наз. коэффициентом распределения или коэф. относит. летучести и т. п.
Частные случаи закона распределения - правила и законы, выражающие равновесное распределение в-ва в двухфазных системах. Напр., для расчета равновесия жидкости и пара пользуются законами Рауля и Генри, первым - для в-ва, находящегося в избытке, вторым - для в-ва, являющегося примесью (см. Генри закон, Рауля закон). Распределение растворенного в-ва между двумя несмешивающимися жидкостями при постоянной т-ре характеризуется тем, что отношение его концентраций в этих двух фазах сохраняется постоянным (закон Бертло - Нернста). Распределение примеси между жидкой и твердой кристаллич. фазой описывается распределениями Хлопина (равновесия) и Дёрнера -Хоскинса (см. Соосаждение).
Законы распределения являются основой разнообразных гетерогенных методов очистки (разделения), хотя само фазовое равновесие в процессе проведения этих методов очистки достигается далеко не всегда, а иногда сама возможность очистки обусловлена отсутствием фазового равновесия (см. Кристаллизационные методы разделения смесей, Ректификация, Экстракция жидкостная).
Лит.: Райнз Ф., Диаграммы фазового равновесия в металлургии, пер. с англ., M., 1960; Сторонкин А. В., Термодинамика гетерогенных систем, ч. 1-2, Л., 1967; Гиб б с Дж. В., Термодинамика. Статистическая механика, пер. с англ., 3 изд., M., 1982; Уэйлес С., Фазовые равновесия в химической технологии, пер. с англ., ч. 1-2, M., 1989. П. И. Федоров.
