Глава 1. Поверхностное натяжение и адсорбция1.1. Поверхностное натяжение
Если система гетерогенна, т.е. состоит по меньшей мере из двух фаз, то между фазами обязательно существует граница раздела. В наиболее общем случае мы имеем дело с поверхностью раздела двух фаз; на состав и свойства этой поверхности влияют любые изменения в любой из двух контактирующих фаз. Хотя мы и говорим «поверхность раздела», в действительности это всегда некоторый переходный слой конечной толщины. С течением времени после соприкосновения фаз будет происходить диффузия молекул каждой из фаз в другую, в результате чего постепенно будет достигнуто равновесное распределение компонентов в объемах контактирующих фаз и на межфазной границе. Однако, состояние вещества на межфазной границе отличается от его состояния в объеме фазы. Можно выделить следующие типы межфазной границы: жидкость-газ (ж/г), жидкость-жидкость (ж/ж), твердое тело-твердое тело (т/т), твердое тело-газ (т/г) и твердое тело-жидкость (т/ж). Чаще всего термин «поверхность» используется в случаях, когда одна из фаз газ или пар. Свойства пограничного слоя, естественно, зависят от свойств соприкасающихся фаз и в первую очередь от сил межмолекулярного притяжения.
Взаимодействия между молекулами в объеме фазы характеризуются разностью энергий притяжения и отталкивания, которые обычно пропорциональны расстоянию Н между молекулами в степенях m и n, соответственно:
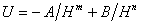 , (1.1.1)
, (1.1.1)
где А и В – постоянные притяжения и отталкивания молекул.
Наиболее известна форма этого уравнения в виде, так называемого, потенциала Ленард-Джонса для парного взаимодействия молекул, не имеющих дипольного момента:
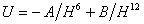 . (1.1.2)
. (1.1.2)
Это уравнение чаще всего используют для оценки энергии взаимодействия молекул, так как недостаточно ясно как природа этого взаимодействия отражается на величине числа B, характеризующего отталкивание. В раде случаев используют уравнения, где показатель степени n изменяется от 9 до 12. Природа молекул сказывается и на показателе степени m, характеризующем изменение энергии притяжения. Если происходит взаимодействие двух ионов, то m=1, что соответствует закону Кулона. Показатель m=2, выражает взаимодействие иона с молекулой, имеющей постоянный диполь, m=4 - взаимодействие иона и индуцированного диполя. Если взаимодействуют мгновенные диполи (в случае дисперсионных сил Лондона), диполь - индуцированный диполь, свободно вращающиеся диполи, то m=6.
Уравнение (1.1.2) относится к взаимодействию двух изолированных частиц (атомов, молекул, ионов). Взаимодействие ансамблей молекул - макроскопических тел - результат суммирования всех видов взаимодействий. Сумма энергии парных взаимодействий является только первым приближением к истинному значению энергии взаимодействия молекул в ансамблях. Энергии коллективного взаимодействия мы рассмотрим несколько позднее, когда перейдем к изучению устойчивости дисперсных систем.
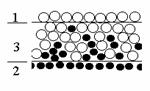
Рис. 1.1. Схема реальной межфазовой поверхности
Изменение энергии межмолекулярного взаимодействия в направлении, перпендикулярном к поверхности раздела фаз, происходит на расстоянии в несколько молекулярных слоев. Вне этой пограничной области проявляются свойства объемных фаз. Схема межфазовой области приведена на рис. 1.1, где 1 – фаза 1; 2 – фаза 2; 3 – межфазовая область. Поскольку энергия межмолекулярного взаимодействия изменяется в зависимости от расстояния между молекулами в большой степени, то можно полагать, что состояние молекул, характерное для фаз, устанавливается на малых расстояниях от межфазной поверхности. Следовательно, каждая фаза содержит две части: одна из них характеризуется объемными свойствами, другая - поверхностными. Так как свойства пограничного слоя не постоянны по толщине и сильно различаются в зависимости от расстояния до граничной поверхности, то возникает необходимость условного выделения такой плоскости внутри пограничного слоя, которая позволила бы разделить свойства системы на «объемные» и «поверхностные». Такое разделение было проведено Гиббсом. Представим, что наряду с реальной системой (см. рис. 1.1), в которой в результате диффузии поверхностный слой содержит два типа молекул (концентрация которых изменяется по толщине этого пограничного слоя) и свойства системы изменяются постепенно при переходе от одной фазы к другой, существует такая идеализированная система, в которой свойства каждой из фаз неизменны во всем объеме, вплоть до некоторой плоскости (математическая или условная геометрическая поверхность), где они скачком переходят в свойства другой фазы. Однако фактические параметры системы в целом отличаются от суммы параметров обеих сосуществующих объемных фаз. Эта разность - положительная или отрицательная - объясняется наличием поверхностного слоя, обладающего свойствами, отличающимися от свойств соприкасающихся фаз. При этих допущениях справедливы следующие соотношения для свойств:
объем
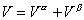 ; (1.1.3)
; (1.1.3)
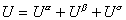 ; (1.1.4)
; (1.1.4)
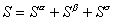 ; (1.1.5)
; (1.1.5)
число молей
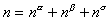 . (1.1.6)
. (1.1.6)
Индексы a, b и s указывают на принадлежность параметра к фазам a, b и к поверхности их раздела (s).
Как следует из химической термодинамики, для идеализированной двухфазной системы без учета поверхности раздела изменение энергии Гиббса описывают уравнением
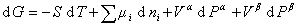 , (1.1.7)
, (1.1.7)где m i– химический потенциал i-го компонента; Рa, Рb– внутреннее давление в фазах a и b; Т – температура.
Для системы с плоской поверхностью раздела
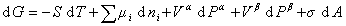 , (1.1.8)
, (1.1.8)
где А – площадь поверхностного натяжения (разделяющая поверхность).

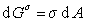 ;
; 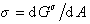 . (1.1.9)
. (1.1.9)
Уравнение (1.1.8) отличается от уравнения (1.1.7) величиной 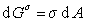 ,показывающей изменение энергии Гиббса при образовании поверхности раздела фаз. Из уравнения (1.1.9) очевидно, что s – избыточная свободная энергия, приходящаяся на единицу площади поверхности. Изложенный выше подход к рассмотрению влияния межфазной границы на свойства системы, предложенный Гиббсом, носит название «метода избыточных величин».
,показывающей изменение энергии Гиббса при образовании поверхности раздела фаз. Из уравнения (1.1.9) очевидно, что s – избыточная свободная энергия, приходящаяся на единицу площади поверхности. Изложенный выше подход к рассмотрению влияния межфазной границы на свойства системы, предложенный Гиббсом, носит название «метода избыточных величин».
Механическая работа dW, необходимая для увеличения площади поверхности, затрачивается на преодоление сил межмолекулярного взаимодействия в объеме фазы. Эта работа внутренних сил пропорциональна площади новой поверхности раздела фаз, т.е.
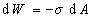 . (1.1.10)
. (1.1.10)
Коэффициент пропорциональности s представляет собой работу внешних сил, необходимую для увеличения межфазной поверхности на единицу площади. Величина s количественно характеризует энергию межмолекулярного взаимодействия, являясь прямой мерой межмолекулярных сил. Если рассматривать границу раздела жидкость-газ, то в этом случае поверхностное натяжение характеризует межмолекулярные силы в одной жидкости. Фоукс (1965 г.) предложил разделить поверхностное натяжение на составляющие, отражающие вклад дисперсионных сил (d), вклад полярных сил, водородной связи, взаимодействия диполей (p) и вклад иных сил (m) в межмолекулярных взаимодействиях. Так, например, для воды
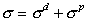 ; (1.1.11)
; (1.1.11)
для ртути
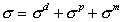 . (1.1.12)
. (1.1.12)
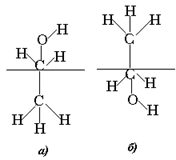
До сих пор мы рассматривали системы с идеализированными сферически симметричными молекулами. Обратимся теперь к рассмотрению ориентации на поверхности асимметричных молекул. Хотя представления об ориентированном расположении асимметричных молекул на поверхности раздела фаз, одна из которых вода, в настоящее время считается общепринятым, рассмотрим вкратце историю развития этого представления. Впервые идею об ориентированном расположении асимметричных молекул на поверхности воды высказали Гарди (1913 г.) и Гаркинс (1918 г.). По мнению этих ученых на поверхности раздела фаз молекулы должны ориентироваться так, чтобы обеспечивался по возможности наиболее постепенный переход свойств от одной фазы к другой. Первая количественная теория адсорбции органических веществ на поверхности жидкости была развита Ленгмюром (1925 г.), предложившим принцип «независимого поверхностного действия», аналогично принципу парахора Сагдена. В соответствии с этим принципом свободная поверхностная энергия молекулы аддитивно складывается из локальной свободной энергии ее частей. В качестве примера рассмотрим возможную ориентацию молекулы этанола на поверхности воды (рис.1.2).
Расчет показывает, что в случае ориентации полярных гидроксильных групп в воздух (см. рис. 1.2, а) свободная поверхностная энергия будет составлять примерно 190 мДж/м2. Ясно, что в соответствии с принципом минимизации свободной энергии предпочтение следует отдать ориентации этанола углеводородными радикалами в воздух (см. рис. 1.2, б). Действительно, измеренное поверхностное натяжение этанола составляет 22,75 мДж/м2 и не очень отличается от поверхностного натяжения углеводородов. Принцип Ленгмюра получил дальнейшее развитие и в настоящее время применяется довольно широко. В частности, для оценки адсорбируемости веществ используется правило Ребиндера, в соответствии с которым на поверхности раздела фаз дифильные молекулы ориентируются так, чтобы компенсировался скачок полярности. Подобное уравнивание полярностей в межфазовой поверхности разрыва возможно, когда полярность третьего компонента оказывается промежуточной между полярностями компонентов, образующих контактирующие фазы.
Рис. 1.2. Схема ориентации дифильных молекул на поверхности жидкости |