Межмолекулярные взаимодействия
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ, взаимод. молекул между собой, не приводящее к разрыву или образованию новых хим. связей. Межмолекулярное взаимодействие определяет отличие реальных газов от идеальных, существование жидкостей и мол. кристаллов. От межмолекулярного взаимодействия зависят мн. структурные, спектральные, термодинамич., теплофиз. и др. св-ва в-в. Появление понятия межмолекулярного взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, к-рый для объяснения св-в реальных газов и жидкостей предложил в 1873 ур-ние состояния, учитывающее межмолекулярное взаимодействие (см. Ван-дер-Ваальса уравнение). Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми.
Виды межмолекулярного взаимодействия. Основу межмолекулярного взаимодействия составляют кулоновские силы взаимод. между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых св-вах в-ва проявляется усредненное взаимод., к-рое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физ. характеристик (ди-польного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярных взаимодействий можно достаточно обоснованно подразделить на три вида-электростатические, поляризационные (индукционные) и дисперсионные. Электростатич. силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризац. силами, если молекулы анизотропны.
При малых расстояниях между молекулами (R ~ l) различать отдельные виды межмолекулярных взаимодействий можно лишь приближенно, при этом, помимо названных трех видов, выделяют еще два, связанные с перекрыванием электронных оболочек, - обменное взаимодействие и взаимодействия, обязанные переносу электронного заряда. Несмотря на нек-рую условность, такое деление в каждом конкретном случае позволяет объяснять природу межмолекулярного взаимодействия и рассчитать его энергию.
Энергия электростатического взаимодействия Vэл-ст представляет собой энергию кулоновского взаимод., вычисленную в предположении, что распределение зарядовой плотности отвечает изолир. молекулам (R = 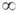 ). В общем случае электрич. потенциал вокруг молекулы изменяется не только по абс. величине, но и по знаку. Если взаимная ориентация двух молекул такова, что область положит. потенциала одной из них приблизительно совпадает с областью, в к-рой локализован отрицат. заряд другой, то Vэл-ст < 0, т. е. электростатич. взаимод. молекул ведет к их притяжению. При R>>l энергия Vэл-ст становится равной сумме энергий взаимод. мультиполей (диполей, квадруполей и т. д.); для полярных молекул главный вклад дает обычно диполь-дипольное взаимодействие. Его энергия Vдип-дип может иметь разный знак в зависимости от ориентации диполей. При ориентации молекул А и В, соответствующей минимуму энергии взаимод., Vдип-дип = — 2pApB/R3, где pА и рB - дипольные моменты молекул А и В соответственно. В газовой фазе, где молекулы почти свободно вращаются, более вероятны такие их взаимные ориентации, к-рые отвечают притяжению диполей. При этом средняя энергия взаимод. равна:
). В общем случае электрич. потенциал вокруг молекулы изменяется не только по абс. величине, но и по знаку. Если взаимная ориентация двух молекул такова, что область положит. потенциала одной из них приблизительно совпадает с областью, в к-рой локализован отрицат. заряд другой, то Vэл-ст < 0, т. е. электростатич. взаимод. молекул ведет к их притяжению. При R>>l энергия Vэл-ст становится равной сумме энергий взаимод. мультиполей (диполей, квадруполей и т. д.); для полярных молекул главный вклад дает обычно диполь-дипольное взаимодействие. Его энергия Vдип-дип может иметь разный знак в зависимости от ориентации диполей. При ориентации молекул А и В, соответствующей минимуму энергии взаимод., Vдип-дип = — 2pApB/R3, где pА и рB - дипольные моменты молекул А и В соответственно. В газовой фазе, где молекулы почти свободно вращаются, более вероятны такие их взаимные ориентации, к-рые отвечают притяжению диполей. При этом средняя энергия взаимод. равна:
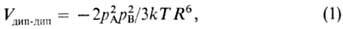
где Т-абс. т-ра, k-постоянная Больцмана. При фиксированной ориентации молекул, напр. в твердом теле, Vдип-дип слабо зависит от Т и изменяется пропорционально R-3. Если взаимодействующие молекулы обладают квадрупольными или более высокого порядка электрич. моментами, в выражение для Vэл-ст входят также слагаемые, отвечающие взаимод. этих мультиполей. По этой причине, в частности, энергетически наиб. выгодная ориентация молекул может отличаться от оптимальной ориентации их дипольных моментов.
П о л я р и з а ц и о н н о е в з а и м о д е й с т в и е обусловлено деформацией электронной оболочки одной молекулы под влиянием электрич. поля другой, что всегда приводит к понижению энергии (притяжению молекул). При больших расстояниях между нейтральными молекулами главный вклад в поляризац. энергию Vпол дает взаимод. постоянного диполя полярной молекулы с индуцированным диполем другой. Поэтому это взаимод. иногда называют индукционным. Согласно ф-ле Дебая,
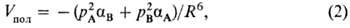
где aА и aB- средние статич. поляризуемости молекул А и В соответственно. Если поляризуемости молекул анизотропны, то в выражении для Vпол появляются дополнит. члены, зависящие от взаимной ориентации молекул.
Межмолекулярное взаимодействие, связанное с переносом электронного заряда с одной молекулы на другую, близко по физ. смыслу к поляризац. межмолекулярному взаимодействию. Перенос заряда происходит при перекрывании электронных оболочек молекул, если их сродство к электрону различно. Перенос заряда можно наглядно рассматривать как "далеко зашедшую" поляризацию, однако энергия межмолекулярного взаимодействия, связанного с переносом заряда, |V|п.з по своему абс. значению существенно меньше | Vпол | и очень быстро (экспоненциально) стремится к нулю с увеличением R. Строго разделить вклады поляризации и переноса заряда в энергию межмолекулярного взаимодействия затруднительно, поэтому часто вычисляют суммарную величину, обозначаемую просто Vпол.
Дисперсионное межмолекулярное взаимодействие определяется корреляцией движения электронов двух взаимодействующих молекул, в результате чего среднее расстояние между электронами этих молекул несколько увеличивается. Это приводит к уменьшению энергии их взаимодействия, т.е. к притяжению молекул. Дисперсионное взаимод. имеет универсальный характер: оно существует между любыми молекулами. Энергия дисперсионного взаимод. Vдисп двух атомов или сферически симметричных молекул при R>>l приближенно описывается ф-л о й Л о н д о н а:
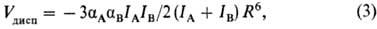
где IА и IB-потенциалы ионизации молекул А и В соответственно. Для молекул иной формы зависимость Vдисп от R и от их физ. характеристик оказывается более сложной (подробнее см. Дисперсионное взаимодействие). При близких расстояниях (R ~ l) дисперсионное межмолекулярное взаимодействие усложняется и обычно наз. корреляционным. Его энергия V м.б. вычислена методами квантовой химии. При сверхдальних расстояниях между молекулами (порядка 100 нм) на их взаимод. начинает сказываться конечность скорости распространения электрич. сигнала (скорости света), в силу чего заряды взаимод. не мгновенно, а с нек-рым запаздыванием; Vдисп оказывается пропорциональным R-7.
Энергия о б м е н н о г о в з а и м о д е й с т в и я молекул Vобм обусловлена тем, что в соответствии с принципом Паули в одном и том же квантовом состоянии не могут находиться два электрона с одинаковыми спинами. Вследствие этого электронная плотность в пространстве между молекулами при перекрывании их электронных оболочек уменьшается (подробнее см. Обменное взаимодействие).
Полная энергия межмолекулярного взаимодействия, или межмолекулярный потенциал, V приблизительно равняется сумме вкладов отдельных видов межмолекулярного взаимодействия:
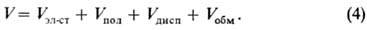
При R >> l последний член обращается в нуль, а первые три можно вычислить по ф-лам (1)-(3). При малых расстояниях между молекулами эти ф-лы, строго говоря, не пригодны для количеств. определения V, однако во мн. случаях они дают правильную качеств. картину межмолекулярного взаимодействия. Если обе или одна из молекул имеет электрич. заряд, то ф-ла (4) остается в силе, однако каждое слагаемое изменится и будет отражать действие дополнит. заряда одной молекулы на другую.
При нек-ром расстоянии R = Re и подходящей взаимной ориентации молекул А и В силы притяжения становятся равными силам отталкивания, потенциал V(R)имеет минимум и система находится в равновесии. Если при этом глубина потенц. ямы больше нулевой энергии межмол. колебания, то молекулы образуют устойчивый комплекс (ассоциат), что подтверждается спектральными данными. Расчеты показывают, что в тех случаях, когда молекулы полярны (или имеют электрич. заряд), наибольший по абс. величине вклад в энергию притяжения при R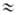 Re дает Vэл-ст. Величина Vобм того же порядка, но она приводит к отталкиванию молекул. Вклады Vпол и V дисп составляют при этом, как правило, от 20 до 40% суммарной энергии притяжения; Vдисп(Vкорр ) играет существ. роль только для межмолекулярного взаимодействия неполярных или слабо полярных молекул (с малым дипольным моментом). Типичная зависимость от R полной энергии взаимод. полярных молекул и отдельных ее вкладов приведена на рис. 1 для димера воды.
Re дает Vэл-ст. Величина Vобм того же порядка, но она приводит к отталкиванию молекул. Вклады Vпол и V дисп составляют при этом, как правило, от 20 до 40% суммарной энергии притяжения; Vдисп(Vкорр ) играет существ. роль только для межмолекулярного взаимодействия неполярных или слабо полярных молекул (с малым дипольным моментом). Типичная зависимость от R полной энергии взаимод. полярных молекул и отдельных ее вкладов приведена на рис. 1 для димера воды.
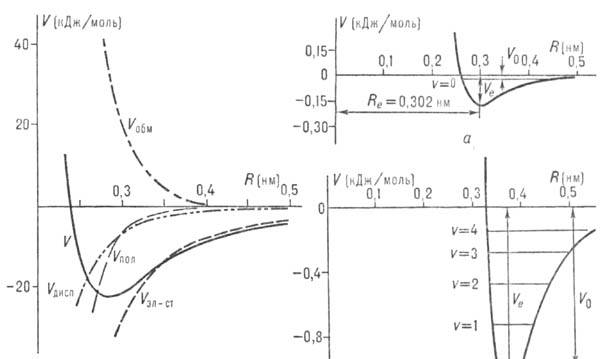

В зависимости от энергии диссоциации различают слабые и сильные мол. комплексы. Наименее устойчивые комплексы, наблюдаемые при низких т-рах, образуют атомы инертных газов. Так, энергия диссоциации комплекса Не•Ne равна 0,02 кДж/моль, комплекса Аr•Аr-1,0 кДж/моль (рис. 2). Низкую энергию диссоциации (1-10 кДж/моль) имеют также комплексы неполярных молекул, напр. (Н2)2, (N2)2, (С2Н4)2, бензол.(Наl)2 и др. Более устойчивые комплексы образуются полярными молекулами. Примером очень прочного ассоциата может служить C5H5N•AlBr3, энергия диссоциации к-рого равна 190 кДж/моль, т.е. сравнима с энергией хим. связи. В газовой фазе существуют не только димеры (HF)2, (H2O)2, HF•H2O и др., но и комплексы из трех и большего числа молекул, напр. (HF)3, (HF)6, (H2O)3, (NH3)3. Для таких ассоциатов циклич. структура, как правило, более устойчива, чем цепочечная. Особую группу образуют ион-молекулярные комплексы, напр. Na+ •(NH3)m, F-•(H2O)m (m = 1, 2, ..., 6), для к-рых энергия отрыва одного лиганда составляет от 80 до 150 кДж/моль.
Специфические межмолекулярные взаимодействия. Частный случай межмолекулярного взаимодействия-водородная связь. От межмолекулярных взаимодействий полярных молекул, не содержащих атомов Н, она в целом не отличается ни по энергии диссоциации (10-100 кДж/моль), ни по относит. величине разл. вкладов в межмол. потенциал; во всех случаях главный вклад в энергию притяжения дает Vэл-ст (кривая на рис. 1 относится к Н-связи НО—Н ...ОН2). Специфично для водородной связи сильное взаимод. разл. колебат. степеней свободы в комплексах. Это приводит, в частности, к длинноволновому смещению и уширению ИК полосы АН-группы (напр., О—Н).
Важный вид мол. комплексов - комплексы с переносом заряда. В их основном квантовом состоянии перенос электронного заряда не более, чем при обычных видах межмолекулярных взаимодействий, однако при возбуждении происходит значит. перенос заряда от одной молекулы (донора) к другой (акцептору); в спектре поглощения появляется дополнит. полоса в ближней УФ области. Пример -мол. комплексы иода (акцептор) с аминами NR3. ИК спектры комплексов с переносом заряда сходны со спектрами комплексов с водородной связью.
Мол. комплексы образуются и при т. наз. резонансном взаимодействии. Оно возникает, как правило, между одинаковыми молекулами, если сначала (при R >> Re)одна из них находится в возбужденном состоянии, а другая-в основном состоянии. При сближении молекул возникают два возбужденных уровня энергии, смещенных в разные стороны по отношению к энергии исходного возбужденного состояния. Величину этого сдвига называют резонансной энергией. Энергия ниж. уровня часто имеет минимум при нек-ром R, что соответствует образованию квазиравновесного комплекса (димера) в возбужденном состоянии (рис. 3).
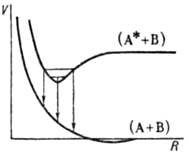
Рис. 3. Кривые потенциальной энергии V для эксимера; (А + В)-основное состояние, (А* + В)-первое электронно-возбужденное состояние. Стрелки указывают пути излучат. перехода из верхнего состояния в нижнее.
Такой комплекс наз. эксимером. Эксимеры с временами жизни порядка 10-8 с наблюдаются, напр., в р-рах красителей. Сходное расположение уровней энергии может возникать и при сближении неодинаковых молекул; образующиеся при этом возбужденные комплексы наз. эксип-лексами.
Многочастичные межмолекулярные взаимодействия. Для системы, состоящей более чем из двух молекул, полная энергия межмолекулярного взаимодействия отличается от суммы парных взаимодействий (неаддитивность). Так, при взаимод. трех частиц А, В, С энергию межмолекулярного взаимодействия можно записать в след. виде:
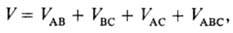
где первые три слагаемых представляют собой энергии парных межмолекулярных взаимодействий, а последний член-энергию тройного межмолекулярного взаимодействия, к-рое обусловливает отступление от аддитивности. Влияние многочастичных взаимод. на св-ва в-в обнаруживается экспериментально даже в случае инертных газов. Напр., равновесные расстояния различны в димерах (в газовой фазе) и в кристаллах вследствие неаддитивности обменной и дисперсионной энергий (электростатич. энергия межмолекулярного взаимодействия всегда аддитивна). Наиб. заметно влияние многочастичных взаимод. для комплексов полярных молекул и для ион-молекулярных комплексов. В них неаддитивность межмолекулярного взаимодействия обусловливают гл. обр. поляризационные силы, причем абс. величина и знак отклонения от аддитивности в энергии зависят от взаимного расположения частиц. Механизм многочастичного взаимод. полярных молекул можно пояснить на примере воды. При последоват. расположении трех молекул
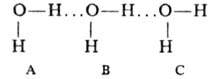
молекула В под влиянием диполя молекулы А поляризуется и ее атомы Н приобретают дополнит. положит. заряд. Благодаря этому взаимод. В с С становится несколько более сильным, чем при парном взаимодействии. При переходе от газовой фазы, содержащей димеры А.В, к конденсированной фазе величины Re уменьшаются, a |V| возрастают. Наряду с многочастичным взаимод. в этот эффект дает вклад также парное диполь-дипольное взаимод. молекул, принадлежащих разным димерам. Установлено экспериментально, что, напр., расстояние Re (F...F)в кристаллах HF меньше на ~ 10%, а |V| больше на ~ 39%, чем в газовой фазе; для воды соотв. значения составляют 6% и ~50%.
Модельные межмолекулярные потенциалы. При больших расстояниях между молекулами (R >> l)зависимость потенциала парного межмолекулярного взаимодействия от R определяют методами возмущений теории, напр. ф-лы (1)-(3). При расстояниях, близких к равновесному Re, зависимость V от R м. б. определена численными методами квантовой химии. Вместе с тем для решения мн. практич. задач важно знать аналит. зависимость V(R). Предложено неск. разл. модельных ф-ций. Эти ф-ции должны удовлетворять трем условиям общего характера: 1) при R =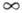 V= 0, 2) при R = Re V(R)имеет минимум, 3) при R < Re V быстро возрастает (отталкивание). Параметры, входящие в выражение для модельного потенциала, выбирают так, чтобы вычисленные с его помощью значения физ. величин, зависящих от межмолекулярного взаимодействия, совпадали или были достаточно близки к значениям, определяемым экспериментально.
V= 0, 2) при R = Re V(R)имеет минимум, 3) при R < Re V быстро возрастает (отталкивание). Параметры, входящие в выражение для модельного потенциала, выбирают так, чтобы вычисленные с его помощью значения физ. величин, зависящих от межмолекулярного взаимодействия, совпадали или были достаточно близки к значениям, определяемым экспериментально.
Одним из распространенных потенциалов является п от е н ц и а л М о р с а (М о р з е):
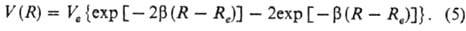
В него входят три эмпирич. параметра: Ve, b и Re. Параметр Ve равен глубине потенц. ямы, связанной с энергией диссоциации V0 мол. комплекса соотношением: Ve = V0 + 1/2 hv, где 1/2 hv - нулевая энергия межмол. колебаний (v- частота этих колебаний, h - постоянная Планка) (см. рис. 2); параметр b определяется из условия, чтобы ф-ция (5) давала правильное значение частоты v; расстояние Re можно определить, напр., из вращат. микроволнового спектра ассоциа-та или одним из дифракц. методов.
На больших расстояниях R ф-ция (5) экспоненциально стремится к нулю, тогда как в действительности потенциал межмолекулярного взаимодействия убывает по степенному закону [согласно ф-лам (1)-(3) как R-6]. Эту закономерность отражает п о т е н ц и а л Л е н-н а р д-Д ж о н с а:
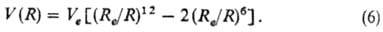
Согласно (6), энергия отталкивания возрастает с уменьшением R пропорционально R-12. Квантовохим. расчеты показывают, однако, что энергия должна возрастать приблизительно экспоненциально, как в потенциале Морса. Правильному поведению при R и R
и R 0 удовлетворяет п о т е н ц и а л Б у к и н г е м а:
0 удовлетворяет п о т е н ц и а л Б у к и н г е м а:
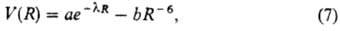
содержащий эмпирич. параметры а, b и l.
Приведенные модельные потенциалы не учитывают взаимной ориентации взаимод. частиц. Для расчета взаимод. многоатомных молекул произвольной формы Т. Хиллом, а затем А.И.Китайгородским был разработан метод атом-атомных потенциалов. Согласно этому методу, межмол. потенциал V записывается в виде суммы потенциалов Vab парных взаимод. каждого атома а одной молекулы с каждым атомом b другой, причем Vab выражается к.-л. простой аналит. ф-цией, напр. потенциалом Букингема (7). Для каждой пары валентно не связанных атомов из эксперимента определяют эффективные значения входящих в Vab параметров, к-рые предполагаются универсальными, не зависящими от того, в какие молекулы входит данная пара атомов. Метод применим к мол. кристаллам, полимерам, сложным мол. комплексам. С его помощью рассчитывают конформации мол. изомеров, взаимные расположения молекул в элементарной ячейке, теплоты сублимации кристаллов и др. Приближенность метода заключается, в частности, в том, что многочастичные взаимод. учитываются только косвенно, выбором эффективных значений параметров в атом-атомном потенциале.
Существует ряд методов, позволяющих в простых случаях определять межмол. потенциалы непосредственно из экспе-рим. данных, не прибегая к модельным потенциалам, напр. по вращательно-колебат. спектрам мол. комплексов, по рассеянию молекул при столкновениях или по данным о вязкости газов.
Межмолекулярные взаимодействия изучают разл. физ. методами, основные из к-рых-молекулярных пучков метод, дифракционные методы, в частности газовая электронография, масс-спектрометрия по-выш. давления, ЯМР, микроволновая спектроскопия, ЯКР, колебат. спектроскопия (инфракрасная и комбинац. рассеяния), вакуумная УФ спектроскопия; изучение температурных зависимостей вириальных коэф., коэф. вязкости, диффузии, теплопроводности и др. Важную роль в исследовании межмолекулярных взаимодействий играют расчетные методы квантовой химии.
Исп. литература для статьи «МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ»: Гиршфельдер Дж., Кертисс Ч., Бэрд Р., Молекулярная теория газов и жидкостей, пер. с англ., М., 1961; Межмолекулярные взаимодействия; от двухатомных молекул до биополимеров, пер. с англ., М., 1981; Каплан И. Г., Введение в теорию межмолекулярных взаимодействий, М., 1982; Molecular interactions, ed. by H. Ratajczak, W.J. Orville-Thomas, v. 1-3, Chichester, 1980-82.
Н.Д. Соколов.
