Сульфаты органические
СУЛЬФАТЫ ОРГАНИЧЕСКИЕ, эфиры серной к-ты. Различают алкил(арил)сульфаты - кислые эфиры серной к-ты
ROSO2OH и их соли, и диалкил(диарил)сульфаты-полные эфиры серной к-ты (RO)2SO2. Известны также орг. пиро-сульфаты-соед. типа ROSO2OSO2X и циклич. сульфаты.
Называют. сульфаты органические, прибавляя суффикс "сульфат" к названию орг. радикалов, напр. (С2Н5О)2SО2-диэтилсульфат; CH3OSO2OC2H5 - метилэтилсульфат; CH3OSO2OH - ме-тилгидросульфат, иди метилсульфат. Для кислых эфиров серной к-ты используют также назв. алкил(арил)серные к-ты. В полифункцион. соединении группу OSO2 называют сульфонилокси, напр. СlSO2О(СН2)2СООН-3-хлорсульфо-нилоксипропионовая к-та.
В ИК спектрах сульфатов органических присутствуют характеристич. полосы в областях 1420-1380 и 1200-1150 см-1, соответствующие колебаниям группы SO2.
Сульфаты органические-высококипящие жидкости или твердые в-ва (см. табл.); алкилсульфаты и их соли, а также низшие диалкил-сульфаты раств. в воде.

Алкил(арил)сульфаты малостабильны и существуют в виде равновесной смеси ROSO2OH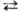 (RO)2SO2 + H2SO4 (равновесие м. б. смещено вправо путем отгонки диалкил-сульфата); являются сильными к-тами, при действии оснований образуют стабильные соли.
(RO)2SO2 + H2SO4 (равновесие м. б. смещено вправо путем отгонки диалкил-сульфата); являются сильными к-тами, при действии оснований образуют стабильные соли.
Гидролизуются сульфаты органические до спиртов; щелочной гидролиз протекает преим. с разрывом связи С—О (механизм SN2), кислотный-с разрывом связи S—О (механизм SN1). Скорость гидролиза полных эфиров значительно больше, чем кислых; диарилсульфаты устойчивее к гидролизу, чем диал-килсульфаты.
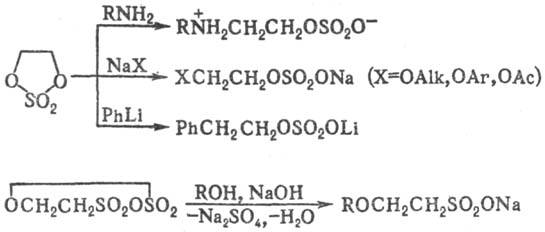
Сульфаты органические реагируют с нуклеоф. реагентами с разрывом связи С—О, благодаря чему они широко используются в орг. синтезе в качестве алкилирующих агентов для спиртов (алкоголятов), тиолов, аминов, амидов и солей карбоновых к-т, галогенидов металлов, металлоорг. соединений (карб-анионов), ароматич. соединений и т. п. В диалкилсульфатах быстро реагирует одна алкильная группа; уходящая группа ROSO2O- относительно инертна. Наиб. высокой реакц. способностью обладают циклические сульфаты органические, напр. этилен-сульфат применяют в орг. синтезе для введения группы CH2CH2OSO2O, карбилсульфат (этан-р-дисультон)-в качестве сульфоэтилирующего реагента:
Диалкилсульфаты сульфируют ароматич. соединения, вступают в р-ции переалкилирования, напр.:
(RO)2SO2 + АrН:ArSO2OR + ROH
(CH3O)2SO2 + CH3COOCH2CH2OC(O)CH3:
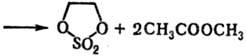
Алкилсульфаты, имеющие 2 и более атома С в алкильной группе, подвергаются термич. разложению с образованием алкенов:
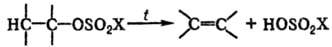
Наиб. склонностью к разложению обладают соед., содержащие трет-алкилы. Так, ди(трет-бутил)сульфат медленно разлагается уже при комнатной т-ре.
Ацилсульфаты в чистом виде не выделены (за исключением перфторацилсульфатов), однако они применяются в качестве промежуточных продуктов в орг. синтезе. Напр., ацетилсульфат в зависимости от природы субстрата проявляет сульфирующее (ароматич. и гетероциклич. соед., кетоны), сульфатирующее (спирты), ацетилирую-щее (амины, фенолы) или смешанное действие (алкены), напр.:
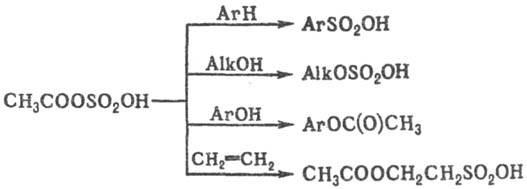
Осн. методы получения сульфатов органических
1) Сульфатирование алкенов Н2SО4-пром. метод синтеза алкил- и диалкилсульфатов. Присоединение H2SO4 происходит по правилу Марковникова:
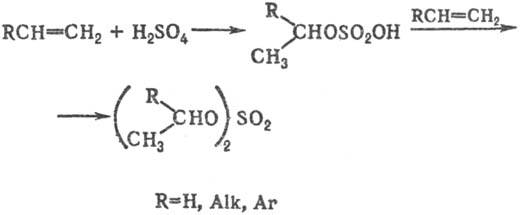
трет-Алкилсульфаты в этих р-циях вьщелить не удается; при гидролизе реакц. массы образуются соответствующие третичные спирты.
Р-ция этилена с SO3 используется в пром-сти для получения карбилсульфата:

2) Сульфатирование спиртов и др. гидроксилсодержащих соединений. При использовании конц. H2SO4 процесс обратим, напр.: C2H5OH + H2SO4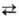 C2H5OSO2OH + Н2О.
C2H5OSO2OH + Н2О.
Для сдвига равновесия вправо применяют избыток H2SO4 либо удаляют воду отгонкой или с помощью дегидратирующих агентов. При переходе от первичных к вторичным спиртам скорость р-ции снижается на порядок. Метод непригоден для получения трет-алкилсульфатов. Сульфатирование с помощью SO3 (ROH + SO3 : ROSO2OH) осуществляется либо его парами, либо в инертных р-рителях (ССl4, SO2, CS2 и др.), или комплексами. SO3 с орг. основаниями (третичные амины, диметилформамид, диоксан и т. п.). В качестве сульфатирующих агентов используют также галогенсульфоновые к-ты, сульфаминовую к-ту или ацетилсульфат. При сульфатировании фенолов во избежание р-ции в ядро применяют мягкие сульфатирующие реагенты (сульфаминовую к-ту или комплексы SO3 с аминами). При вэаимод. спиртов с SO2Cl2 образуются алкил(арил)хлорсульфаты и далее диалкил(диарил)суль-фаты:
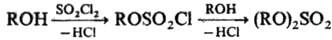
Этим методом получают трет-алкилзамещенные сульфаты, напр. ди (трет-бутил)сульфат.
В качестве сульфатирующего агента для гидропероксидов или в р-циях сульфоокисления можно применять SO2:
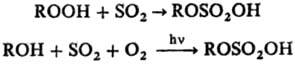
Сульфатирование высших спиртов используют в пром. произ-ве ПАВ (см. Алкилсульфаты). Сульфатирование гид-роксильных групп широко применяют в пром-сти для модификации разл. в-в.
3) Расщепление простых эфиров при действии на них H2SO4 или галогенсульфоновых к-т, напр.:
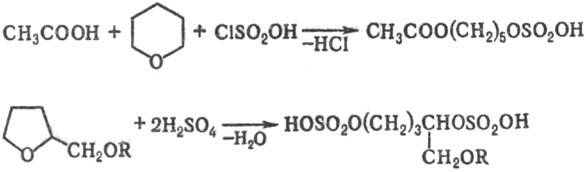
Взаимод. простых эфиров с SO3 приводит к диалкилсуль-фатам (р-ция протекает через стадию образования комплекса), напр.:
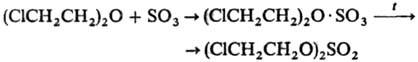
Этот способ применяют также для синтеза циклических сульфатов органических, напр.:
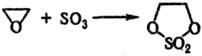
4) Сульфатирование фенолов, ароматич. аминов, хинонов. Фенолы и ароматич. амины сульфатируются персульфатами калия или аммония в ядро, образуя n-гидрокси- или n-аминофенилсульфаты (промежут. стадия р-ции Эльбса), напр.:
С6Н5ОН + K2S2O8 : n-HOC6H4OSO2OK + KHSO4
Сульфатирование хинонов в ядро осуществляют действием SO3 в присут. аминов; этот способ используют в пром-сти для получения водорастворимых форм антра-хиноновых красителей.
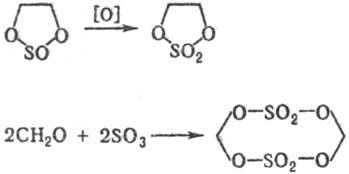
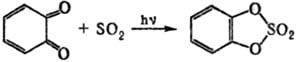
5) Циклические сульфаты органические получают: окислением циклич. сульфитов; р-цией SO3 с формальдегидом или др. альдегидами, не имеющими a-H-атома; фотохим. присоединением SO2 к o-хинону или его аналогам, напр.:
Качеств. и количеств. определение сульфатов органических основано на их гидролизе с послед. определением соответствующего спирта и сульфатной группы.
Сульфаты органические широко используют в орг. синтезе в качестве алкилирующих агентов. Соли высших алкилсульфатов -ПАВ разл. назначения (эмульгаторы, смачиватели и т.п.). Введение сульфатных групп в структуру целлюлозы, са-харов, биологически активных в-в, красителей и др. в-в применяют для получения их водорастворимых форм. Физиол. активность сульфатов органических обусловлена их алкилирующим действием по отношению к белкам и углеводам в сочетании с гидролизом до ROSO2OH и H2SO4.
Низшие диалкилсульфаты в парах раздражают слизистые оболочки глаз и верх. дыхат. путей, в больших концентрациях поражают легочную ткань, в жидком состоянии вызывают раздражение и некроз кожи, при попадании внутрь обладают общеядовитым действием: Алкил- и арилсерные к-ты действуют на организм подобно др. сильным к-там. Высшие алкилсульфаты и диалкилсульфаты малотоксичны.
См. также Диметилсулъфат, Метилсерная кислота.
Лит.: Джильберт Э. Э., Сульфирование органических соединений, пер. с англ., М., 1969; Сигэру Оаэ, Химия органических соединений серы, пер. с япон., М., 1975; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 556-62. А. Ф. Ермолов.
