Алкоголяты
АЛКОГОЛЯТЫ, продукты замещения атома Н в молекуле спирта на металл (М).
Алкоголяты одноатомных спиртов. Их общая ф-ла M(OR)n, где n-степень окисления металла. Алкоголяты щелочных, щел.-зем. металлов, Т1(1) и первичных спиртов-ионные соед.; неплавки, нелетучи; т. разл. 200-300 °С; раств. в спиртах и жидком NH3; электролиты в р-ре. Из спиртовых р-ров обычно выделяются в виде кристаллосольватов. Производные металлов III-VIII групп и спиртов (начиная с С2Н5ОН), а также M1OR-mpem- молекулярные мономерные или олигомерные соед.; имеют низкие т-ры плавления и кипения; хорошо раств. в неполярных р-рителях, плохо-в спиртах; р-ры не проводят ток. Метилаты тех же элементов-обычно координац. полимеры; неплавки, нелетучи; не раств. ни в одном из р-рителей. Большинство алкоголятов элементов середины периодич. системы сочетают св-ва ионных и молекулярных соед. (см. табл.). Все алкоголяты очень гигроскопичны.
ХАРАКТЕРИСТИКА АЛКОГОЛЯТОВ [М(ОН)n]m 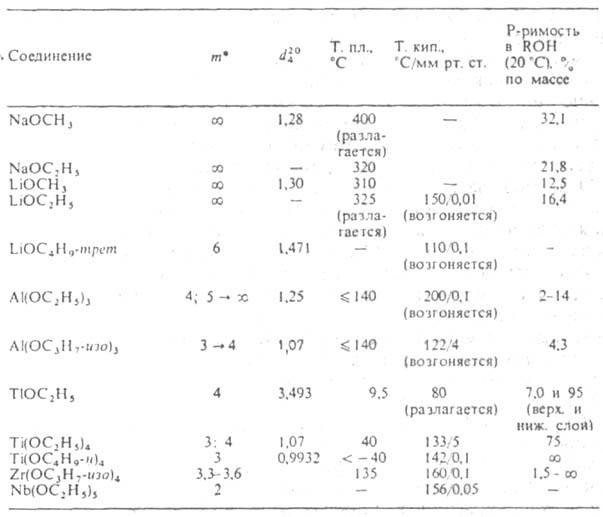
* т-степень ассоциации; стрелкой показано изменение т при старении.
С удлинением R в гомологич. рядах т-ра плавления, плотность, показатель преломления, р-римость в спирте обычно снижаются, а т-ра кипения (возгонки), Н и
Н и S испарения, вязкость увеличиваются. Пространств. затруднения, возрастающие при переходе от первичных R к вторичным и третичным, препятствуют ассоциации молекул. В этом же ряду снижаются т-ра кипения (см. рис. 1), вязкость и возрастает р-римость в неполярных р-рителях. Алкоголяты ряда многовалентных металлов, напр. Al, Ga, Ti, Fe(III), образуют неск. ассоциатов разл. состава и строения (напр., ф-лы VI и IX). Их олигомерные и полимерные молекулы способны к взаимным превращ., поэтому физ.-хим. св-ва и реакц. способность отдельных препаратов алкоголятов могут изменяться в весьма широких пределах (см. рис. 2).
S испарения, вязкость увеличиваются. Пространств. затруднения, возрастающие при переходе от первичных R к вторичным и третичным, препятствуют ассоциации молекул. В этом же ряду снижаются т-ра кипения (см. рис. 1), вязкость и возрастает р-римость в неполярных р-рителях. Алкоголяты ряда многовалентных металлов, напр. Al, Ga, Ti, Fe(III), образуют неск. ассоциатов разл. состава и строения (напр., ф-лы VI и IX). Их олигомерные и полимерные молекулы способны к взаимным превращ., поэтому физ.-хим. св-ва и реакц. способность отдельных препаратов алкоголятов могут изменяться в весьма широких пределах (см. рис. 2).
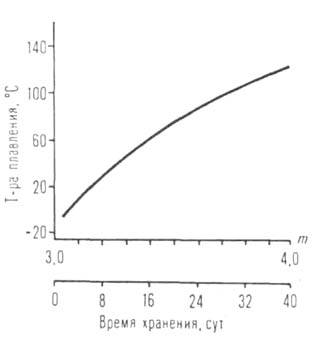
Рис. I. Зависимость температуры кипения изомерных амилатов Ti, Mb, Al, U от разветвленности R. 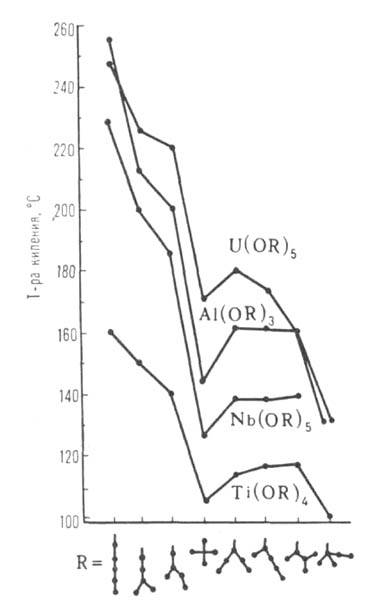
Рис. 2. Зависимость температуры плавления [Аl(ОС3Н7-изо)з]т от степени ассоциации (т) и времени хранения (с момента начала кристаллизации).
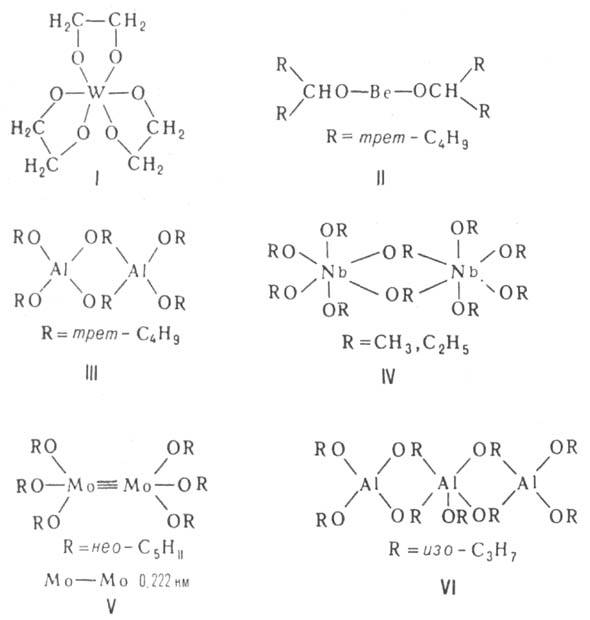
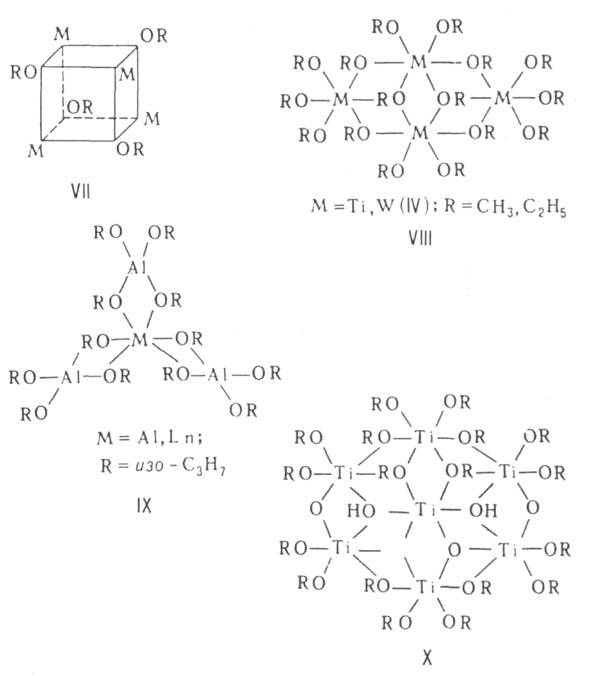
Строение ассоциатов определяется принципом "миним. степени полимеризации", согласно к-рому все атомы М достигают устойчивых координац. чисел (благодаря донорно-акцепторному взаимод. между своб. орбиталями М и парами электронов атомов О алкоксильных групп соседних молекул). Алкоголяты мономерны только в случае полидентатных или очень разветвленных алкоксилов (см. ф-лы I, II). Ассоциаты могут иметь разнообразное строение. Димеры способны образовать структуру из двух многогранников, напр. тетраэдров (III) или октаэдров (IV) с общим ребром (OR)2, кластеры Мо или W, содержащие кратные связи М—M(V). Молекулы тримеров представляют собой обычно циклоли-нейные цепочки (VI), тетрамеров-кубаны (ТЮСН3, КОС4Н9-трет, CH3ZnOCH3, VII), плоские молекулы из четырех октаэдров с общими ребрами (VIII) или молекулы с центральным октаэдром и тремя тетраэдрами по его ребрам (IX). Метилаты, этилаты и изопропилаты щелочных и щел.-зем. металлов образуют полимерные кристаллич. структуры из слоев тетраэдров (типа анти-РbО) и октаэдров [типа Са(ОН)2] соответственно.
Комплексообразование со спиртами, сопровождающееся выделением устойчивых кристаллосольватов [напр., LiOCH3*2CH3OH, т. разл. 28°С; NaOC2H5*2C2H5OH, т. разл. 200°С; Са(ОС2Н5)2*nС2Н5ОН, где п = 4 и 2, т. разл. 60 и 100°С], свойственно гл. обр. алкоголятам щелочных и щел.-зем. металлов; в случае многовалентных металлов сольваты со спиртами и др. основаниями Льюиса малоустойчивы, т.к. акцепторная ф-ция М удовлетворяется благодаря образованию прочных OR-мостиков в молекулах ассоциатов. Известны сольваты [М (ОС3Н7-изо)4*L]2, где М = Sn, Zr; L = = изо-С3Н7ОН, ТГФ, пиридин, 2Ti(OR)4*En, 2А1(ОС3Н7-изо)3*Еn [En=(—CH2NH2)2], легко подвергающиеся десольватации. Вместе с тем Al [OCH(CF3)2]3*L [L = (C2H5)2O, (C2H5)3N, (C2H5)3P] перегоняются в вакууме без разложения.
При взаимод. двух разл. алкоголятов в р-ре или расплаве образуются биметаллич. алкоголяты (алкоксосоли Меервейна), для к-рых более характерны св-ва молекулярных соед., чем для компонентов, образующих их. Так, Mg[Al(OC2H5)4]2 в отличие от полимерных этилатов Mg и А1 неограниченно раств. в орг. р-рителях, перегоняется при 195°С/0,1 мм рт.ст. (т. пл. 181°С), образует димеры, весьма устойчивые в газовой фазе и р-ре. Комплексообразование алкоголятов с галогенидами металлов приводит к алкоксогалогенидам —М (OR)nHalm. Ангидриды минер. к-т при взаимод. с алкоголятами образуют соли алкилированных к-т:
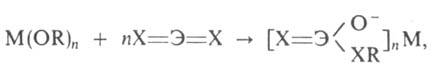
где ЭХ2 = СО2, SO2, CS2; M = Na, Си. Алкоголяты типа (изо-RO)3Mo=Mo(OR-изо)3 обратимо связывает СО, СО2 и необратимо - О2, NO, C2H2; присоединенные лиганды L (за исключением О2 и NO) становятся мостиковыми:
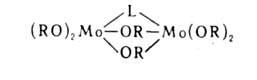
С соед., содержащими активный атом Н, алкоголяты вступают в р-цию обмена: М (OR)n + п НХ -> МХn + n ROH, где X = Hal, ОН, OR, SH, NH2 и др. Р-цию широко применяют в синтезе безводных неорг. и орг. производных металлов, т.к. единственный побочный продукт в этом случае-спирт.
При контролируемом гидролизе алкоголятов многовалентных металлов следами влаги кристаллизуют продукты, содержащие оксо-мостики (см., напр., ф-лу X). Конечные продукты гидролиза алкоголятов - гидроксиды; они отличаются высокой реакц. способностью, образуют устойчивые гидрогели и дегидратируются при весьма низких т-рах с образованием мелкодисперсных оксидов.
В окислит.-восстановит. р-ции, сопровождающиеся изменением степени окисления М, вступают в осн. алкоголяты переходных металлов (р-цию используют для получения алкоголятов тех же металлов в новых степенях окисления).
Алкоголяты щелочных или щел.-зем. металлов получают взаимод. металла со спиртом. Иногда эту р-цию проводят в р-ре углеводорода или жидкого NH3. Бериллий, Al, Y, Ln реагируют со спиртами в присут. HgCl2, I2, HHal или галогенидов тех же металлов. Алкоголяты Ge, Ti, Zr, Nb, Та, Y, Sc и La получают анодным окислением металла в спирте в присут. электропроводной добавки [R4N] Br. Алкоголяты щелочных, щел.-зем. металлов, T1(I), V(V), Mo (VI), Re (VII), Os (VIII) получают также алкоголизом их оксидов или гидроксидов:
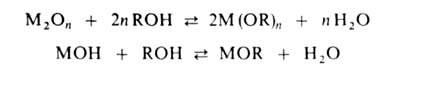
Равновесие смещают вправо связыванием или удалением воды отгонкой. Достаточно универсален метод синтеза алкоголятов алкоголизом ряда соед.:
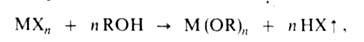
где X = Н, R', NH2, NR2, N[Si(CH3)3]2- Однако применение этого метода ограничено трудностями синтеза МХn. Алкоголяты синтезируют также алкоксилированием хлоридов металлов щелочными алкоголятами или смесью NH3 с ROH, обычно в спиртовом или спирто-бензольном р-ре, напр.:
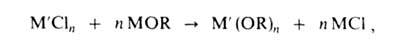
где М = Na, Li, NR4; n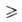 3. В синтезе р-римых алкоголятов используют NaOR (NaCl выпадает в осадок), в синтезе нерастворимых, напр. мeтилaтoв,-LiOR (LiCl раств. в СН3ОН). Р-ция протекает через образование биметаллич. алкоголятов. Модификация метода - взаимод. легкодоступных пиридиниевых солей хлорометаллатов с NH3:
3. В синтезе р-римых алкоголятов используют NaOR (NaCl выпадает в осадок), в синтезе нерастворимых, напр. мeтилaтoв,-LiOR (LiCl раств. в СН3ОН). Р-ция протекает через образование биметаллич. алкоголятов. Модификация метода - взаимод. легкодоступных пиридиниевых солей хлорометаллатов с NH3:
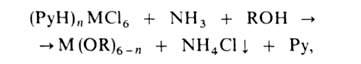
где Ру = пиридин, М = Zr, Ce(IV), Pu(IV), UO3+ , UO22+. Равновесие "переэтерификации" алкоголята др. спиртом: М (OR)n + п R'OH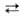 М (OR')n + п ROH сдвигают вправо отгонкой азеотропа ROH с бензолом или многократным введением новых порций ROH. В случае близких т-р кипения обоих спиртов целесообразна замена ROH сложным эфиром:
М (OR')n + п ROH сдвигают вправо отгонкой азеотропа ROH с бензолом или многократным введением новых порций ROH. В случае близких т-р кипения обоих спиртов целесообразна замена ROH сложным эфиром:
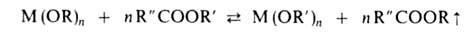
Алкоголяты ряда переходных металлов м. б. получены окислит.-восстановит. р-циями, напр. окислением Cr(OR-трет)3 кислородом, бромом или Рb(СН3СОО)4 до Cr(OR-трет)4. Окислителями служат сложные эфиры, напр. U(OR)5 превращ. при их действии в U(OR)6. Восстановление (NH4)2CrO4 в спиртовом р-ре под действием УФ-облучения приводит к Cr(OR)3; Ti(OR)4 восстанавливается металлич. К до Ti(OR)3.
Алкоголяты одноатомных спиртов используют для селективного восстановления группы С=О (см. Меервепна-Понндорфа-Верлея реакция, Оппеиауэра реакция), как катализаторы диспропорционирования альдегидов (см. Тищенко реакция), конденсации, полимеризации и др. Щелочные алкоголяты-алкоксилирующие агенты (см. Вильямсона синтез). Алкоголяты А1 и Ti-гидрофобизаторы и сшивающие агенты для эпоксидных и полиэфирных смол, кремнийорг. полимеров. Продукты частичного гидролиза и пиролиза алкоголятов-полиорганометаллоксаны-компоненты термостойких покрытий. Из алкоголятов в результате их гидролиза, пиролиза или окисления получают высокочистые и активные оксиды металлов.
Алкоголяты гликолей и многоатомных спиртов. Наиб. изучены алкоголяты глицерина (глицераты) и алкоголяты гликолей (гликоляты).
Алкоголяты многоатомных спиртов и гликолей -хелаты (мономерные, олигомерные) или полимеры, содержащие полидентатные лиганды. Хелаты встречаются чаще всего среди алкоголятов с не полностью замещенными группами ОН в исходном спирте (напр., ф-ла XI). Такие алкоголяты склонны к образованию сольватов с любыми спиртами. Представляют собой гигроскопичные кристаллы; производные щелочных и щел.-зем. металлов раств. в спиртах, разлагаются ниже 200°С, производные многова-. лентных металлов (Со, Ti или др.) раств. также в неполярных р-рителях, летучи и низкоплавки. Полностью замещенные алкоголяты-аморфные полимеры, реже-кристаллические (напр., глицерат Со ф-лы XII). В отличие от M(OAlk)n они устойчивы к гидролизу, нерастворимы, неплавки, термостойки.
Однозамещенные алкоголяты образуются действием на многоатомные спирты и диолы избытка щелочного, щел.-зем. металла или MOAlk; полностью замещенные алкоголяты тех же металлов-диспропорционированием при высоких т-рах:
2NaO(CH2)2OH NaO(CH2)2ONa + НО(СН2)2ОН
NaO(CH2)2ONa + НО(СН2)2ОН
Двухзамещенные гликоляты и трехзамещенные глицераты многовалентных металлов получают взаимод. оксидов, гидроксидов, М (ОА1к)n, оксалатов, ацетатов соотв. с гликолем или глицерином при т-рах выше 250°С.
Особый класс - пирофорные продукты взаимод. СО со щелочными или щел.-зем. металлами (считавшиеся раньше "солями гексаоксибензола"). Они представляют собой двухзамещенные производные гипотетич. ацетилендиола НОС СОН.
СОН.
Литература
Турова Н. Я.. Новоселова А. В., "Успехи химии", 1965. т. 34, в. 3, с. 385-433; Пенкось Р., там же, 1968, т. 37, в. 4, с. 647-76; Брэдл и Д., там же, 1979, т. 47, в. 4, с. 638-78; Новоселова А.В. [и др.], "Изв. АН СССР, Сер. неорг. материалы", 1979, т. 15, № 6, с. 1055-67; Шрейдер В. А. [и др.], "Изв. АН СССР, Сер. хим.", 1981, № 8, с. 1687-92. Н.Я. Турова.
