Кислотные свойства продуктов присоединения солей к спиртам
Константы диссоциации спиртов лежат ниже 10–14. Таким образом, алкоголи являются крайне слабыми «кислотами» — более слабыми, чем вода. Это обстоятельство указывает на очень малую устойчивость спиртовых анионов (алкоголят-ионов) [R—О]-. Однако при растворении в алкоголях галогенидов некоторых металлов, например ZnCl2, AlCl3, а также алкоголятов алюминия, магния и некоторых других, получаются соединения
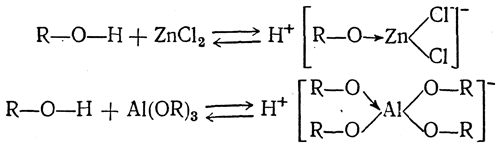
обладающие несравненно более высокой кислотностью, чем соответствующие спирты. Это значит, что возникшие комплексные анионы обладают большей устойчивостью. Эта устойчивость обусловлена выделением энергии, которым сопровождается образование такого комплексного аниона.
Вещества, которые при растворении активируют атомы водорода в молекулах растворителя, так что эти молекулы становятся способными диссоциировать, образуя ионы водорода или комплексные ионы типа Н3О+ (в случае воды), было предложено называть ансольвокислотами по аналогии с ангидрокислотами (ангидридами аквокислот). С этой точки зрения ZnCl2, AlCl3, Аl(ОС3Н7)3 и т. п. должны рассматриваться как ансольвокислоты.
В некоторых случаях кислоты, образующиеся из спиртов, оказываются очень сильными кислотами, способными без разложения перегоняться в вакууме. Таковы комплексные соединения с трехфтористым бором типа BF3 · ROH:
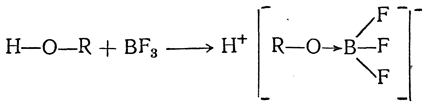
Кроме соединений BF3 · ROH, известны соединения типа BF3 · 2ROH.


