Кислоты и основания
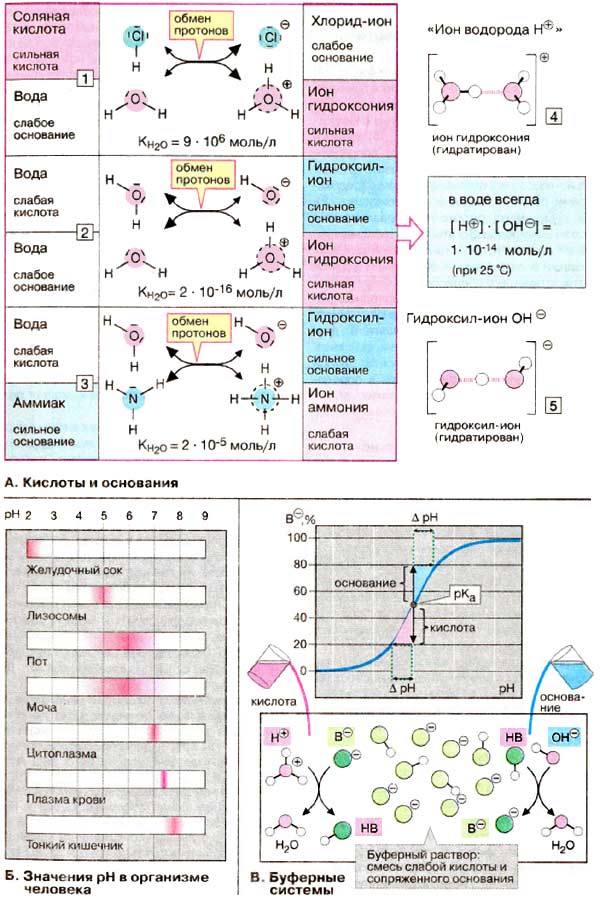
Кислотами принято называть вещества, способные отдавать протоны (ионы водорода), а основаниями — вещества, способные принимать протоны. Вода усиливает кислотно-основные свойства растворенных веществ, поскольку может выполнять функции как кислоты, так и основания. Так, соляная кислота (HCl) отдает протоны молекулам воды (1). При этом образуются анион хлора (Cl-) и протонированные молекулы воды (ионы гидроксония, H3O+, для краткости обозначаемые H+). Обмен протонами между HCl и водой идет почти количественно, т.е. в воде HCl ведет себя как сильная кислота.
Основания, например аммиак (NH3), принимают протоны у молекул воды с образованием гидроксил-ионов (OH- ) и положительно заряженных ионов аммония (NH4+, 3). Как и все ионы, гидроксоний и гидроксил присутствуют в воде в гидратированной форме (4 и 5).
В кислотно-основных реакциях всегда принимают участие кислота и сопряженное с ней основание. Чем более сильной является кислота (или основание), тем слабее сопряженное основание (или кислота). Например, очень слабое основание анион хлора сопряжен с очень сильной соляной кислотой (1). Слабокислый ион аммония сопряжен с умеренно сильным основанием аммиаком (3). Если молекула воды функционирует как слабая кислота, образуется гидроксил-ион — очень сильное основание. Если вода выступает как основание, образуется ион гидроксония — очень сильная кислота (2).
Константа диссоциации воды (2) — величина ничтожно низкая:
КН2O = ([H+ ] [H + ][OH - ]) / [H2O] = 2 · 10-16 моль/л (при 25oC)
В чистой воде концентрация молекул воды [H2O] — величина практически постоянная, равная 55 моль/л. При подстановке этого значения в уравнение оно принимает вид
KW= [H+ ][OH- ] = 1 · 10-14 моль/л
Таким образом, произведение [H+ ] · [OH- ], так называемое ионное произведение воды, есть величина постоянная, даже в присутствии в растворе других кислотно-основных пар. При 25оС концентрации ионов H+ и ОН- в чистой воде равны и составляют 1 · 10-7 моль/л.
Б. Значения pH в организме человека
В клетках и межклеточных жидкостях pH поддерживается на относительно постоянном уровне. В крови величина pH обычно меняется в пределах 7,35-7,45. Это соответствует изменению концентрации водородных ионов не более чем на 30%. В цитоплазме pH составляет 7,0-7,3. что несколько меньше, чeм в крови. В лизосомах (см. с. 228, pH 4,5-5,5) концентрация водородных ионов более чем в 100 раз выше по сравнению с концентрацией в цитоплазме.
В пищеварительном тракте, который для организма является как бы внешним миром. и в выделениях организма pH варьирует в существенно большей степени. Экстремальные величины pH (около 2) наблюдаются в желудке и в тонком кишечнике (>8). E связи с тем, что почки могут выделять как кислоты, так и основания. значительные вариации pH (4,8-7,5) наблюдаются в моче.
Краткосрочные колебания pH в организме компенсируются буферными системами. Буферная система представляется собой смесь слабой кислоты HB и сопряженного с ней основания В- или слабого основания и сопряженной с ним кислоты. Такие системы могут нейтрализовать избыток как ионов гидроксония, так и гидроксил-ионов. В первом случае избыток протонов связывается основанием В- с образование воды к кислоты в недиссоциированной форме. Гидроксил-ионы взаимодействуют с HВ с образованием В- и воды. В обоих случаях прежде всего сдвигается соотношение [НВ]/[В- ], а pH изменяется очень незначительно. На кривой титрования видно, что буферные системы работают наиболее эффективно в области pH, соответствующей рКа кислоты. В этой области график имеет максимальную крутизну, и при добавлении определенного количества кислоты или основания ΔрН минимально. Другими словами, буферная емкость системы максимальна при рКа.


