Буферные системы
Буферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований.
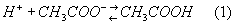 |
Примером буферной системы служит смесь растворов уксусной кислоты CH3COOH и её натриевой соли CH3COONa. Эта соль как сильный электролит диссоциирует практически нацело, т. е. даёт много ионов CH3COO-. При добавлении к буферной системе сильной кислоты, дающей много ионов Н+, эти ионы связываются ионами CH3COO- и образуют слабую (то есть мало диссоциирующую) уксусную кислоту:
Наоборот, при подщелачивании буферной системы, то есть при добавлении сильного основания (например, NaOH), ионы OH- связываются Н+-ионами, имеющимися в буферной системе благодаря диссоциации уксусной кислоты; при этом образуется очень слабый электролит — вода:
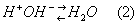 |
По мере расходования Н+-ионов на связывание ионов OH- диссоциируют всё новые и новые молекулы CH3COOH, так что равновесие (1) смещается влево. В результате, как в случае добавления Н+-ионов, так и в случае добавления ОН--ионов, эти ионы связываются и потому кислотность раствора практически не меняется.
Кислотность растворов принято выражать так называемым водородным показателем pH (для нейтральных растворов pH=7, для кислых — pH меньше, а для щелочных — больше 7). Приливание к 1 л чистой воды 100 мл 0,01 молярного раствора HCl (0,01 М) изменяет pH от 7 до 3. Приливание того же раствора к 1 л буферной системы CH3COOH + CH3COONa (0,1 М) изменит pH от 4,7 до 4,65, то есть всего на 0,05. В присутствии 100 мл 0,01 М раствора NaOH в чистой воде pH изменится от 7 до 11, а в указанной буферной системе лишь от 4,7 до 4,8. Кроме рассмотренного, имеются многочисленные другие буферные системы (примеры см. в табл.). Кислотность (и, следовательно, pH) буферной системы зависит от природы компонентов, их концентрации, а для некоторых буферных систем и от температуры. Для каждой буферной системы pH остаётся примерно постоянным лишь до определённого предела, зависящего от концентрации компонентов.
Примеры буферных систем
| Компоненты (концентрации по 0,1 г мол/л) | pH (при 15—250C) |
| Уксусная кислота + ацетат натрия, CH3COOH + CH3COONa | 4,7 |
| Лимоннокислый натрий (двузамещеный), C6H6O7Na2 | 5,0 |
| Н3ВО3 + Na2B4O7 10H2O | 8,5 |
| Борная кислота + едкий натр, Н3ВО3 + NaOH. | 9,2 |
| Фосфат натрия (двузамещеный)+ + едкий натр, Na2HPO4 + NaOH | 11,5 |
Буферные системы широко используются в аналитической практике и в химическом производстве, так как многие химические реакции идут в нужном направлении и с достаточной скоростью лишь в узких пределах pH. Буферные системы имеют важнейшее значение для жизнедеятельности организмов; они определяют постоянство кислотности различных биологических жидкостей (крови, лимфы, межклеточных жидкостей). Основные буферные системы организма животных и человека: бикарбонатная (угольная кислота и её соли), фосфатная (фосфорная кислота и её соли), белки (их буферные свойства определяются наличием основных и кислотных групп). Белки крови (прежде всего гемоглобин, обусловливающий около 75% буферной способности крови) обеспечивают относительную устойчивость pH крови. У человека pH крови равен 7,35—7,47 и сохраняется в этих пределах даже при значительных изменениях питания и др. условий. Чтобы сдвинуть pH крови в щелочную сторону, необходимо добавить к ней в 40—70 раз больше щёлочи, чем к равному объёму чистой воды. Естественные буферные системы в почве играют большую роль в сохранении плодородия полей.
В. Л. Василевский.
