Водородный показатель
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН), равен -lg aH, где aH-термодинамич. активность ионов Н+ в р-ре (в моль/л). Водородный показатель - количеств. характеристика кислотности водных р-ров. Вода диссоциирует на ионы Н + и ОН-. Константа равновесия этого процесса при 22 °С:
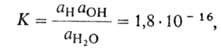
где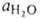 и aOH-термодинамич. активности соотв. воды и ОН ~ (в моль/л). Обозначив произведение aH*aOH через КB(ионное произведение воды) и учитывая, что в 1 л содержится 55,5 моля Н2О, получим: КB =
и aOH-термодинамич. активности соотв. воды и ОН ~ (в моль/л). Обозначив произведение aH*aOH через КB(ионное произведение воды) и учитывая, что в 1 л содержится 55,5 моля Н2О, получим: КB =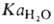 =10-14. В чистой воде, как и в любых др. нейтральных р-рах, aH = aOH = = 10-7 и, следовательно, рН = 7. При добавлении в
=10-14. В чистой воде, как и в любых др. нейтральных р-рах, aH = aOH = = 10-7 и, следовательно, рН = 7. При добавлении в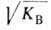 р-р к-ты рН становится меньше 7, при добавлении щелочи - больше 7. Обычно определяют рН с помощью кислотно-основных индикаторов (используемых в виде р-ров или реактивных индикаторных бумаг), более точно-потенциометрически.
р-р к-ты рН становится меньше 7, при добавлении щелочи - больше 7. Обычно определяют рН с помощью кислотно-основных индикаторов (используемых в виде р-ров или реактивных индикаторных бумаг), более точно-потенциометрически.
Комментарии*
Дополнения:
- Определение: pH = -log₁₀[H⁺], где [H⁺] — концентрация ионов водорода в моль/л. В разбавленных растворах активность (aH) приблизительно равна концентрации.
- Шкала pH: Стандартная шкала от 0 до 14 при 25°C, где:
- pH < 7 — кислая среда
- pH = 7 — нейтральная среда
- pH > 7 — щелочная (основная) среда
- Зависимость от температуры: Ионное произведение воды (K_w) изменяется с температурой. Например, при 100°C K_w ≈ 10⁻¹², поэтому нейтральный pH = 6.
- Значимость: Критически важный параметр в:
- Биохимии (ферментативная активность, кислотно-щелочной баланс крови)
- Медицине (диагностика)
- Пищевой промышленности
- Экологическом мониторинге (качество воды)
- Химической технологии
*Подобраны с помощью LLM, верифицированы, но возможны неточности.
Синонимы/примеры:*
pH; водородный показатель
*подобраны ИИ, возможны неточности
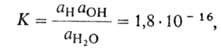
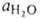 и aOH-термодинамич. активности соотв. воды и ОН ~ (в моль/л). Обозначив произведение aH*aOH через КB(ионное произведение воды) и учитывая, что в 1 л содержится 55,5 моля Н2О, получим: КB =
и aOH-термодинамич. активности соотв. воды и ОН ~ (в моль/л). Обозначив произведение aH*aOH через КB(ионное произведение воды) и учитывая, что в 1 л содержится 55,5 моля Н2О, получим: КB =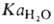 =10-14. В чистой воде, как и в любых др. нейтральных р-рах, aH = aOH = = 10-7 и, следовательно, рН = 7. При добавлении в
=10-14. В чистой воде, как и в любых др. нейтральных р-рах, aH = aOH = = 10-7 и, следовательно, рН = 7. При добавлении в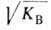 р-р к-ты рН становится меньше 7, при добавлении щелочи - больше 7. Обычно определяют рН с помощью кислотно-основных индикаторов (используемых в виде р-ров или реактивных индикаторных бумаг), более точно-потенциометрически.
р-р к-ты рН становится меньше 7, при добавлении щелочи - больше 7. Обычно определяют рН с помощью кислотно-основных индикаторов (используемых в виде р-ров или реактивных индикаторных бумаг), более точно-потенциометрически. 
Дополнения: