Вода
Синонимы:
водорода гидроокисьоксид водорода
оксид диводорода
Внешний вид:
бесцветн. жидкость Кристаллические модификации, цвет растворов и паров:
В твердом виде образует несколько модификаций: Ih (гексагональная структура) существует при 0 C, плотность 0,917 г/см3; Ic (кубическая модификация), существует при -133 C, плотность 0,93 г/см3; II (при -33 C и 210 МПа), плотность 1,18 г/см3; III (при -22 C и 200 МПа), плотность 1,15 г/см3; V (при -5 С и 800 МПа), плотность 1,26 г/см3; VI (при +35 С и 800 МПа), плотность 1,34 г/см3; VII (при 25 С и 2500 МПа), плотность 1,65 г/см3.В толстом слое имеет голубой цвет.
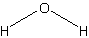
Брутто-формула (система Хилла): H2O
Формула в виде текста: H2O
Молекулярная масса (в а.е.м.): 18,02
Температура плавления (в °C): 0
Температура кипения (в °C): 100
Температурные константы смесей:
126 °C (температура кипения азеотропа, давление 1 атм) бромоводород 47,5% вода 52,5%
105 °C (температура кипения азеотропа, давление 1 атм) бромоводород 10,4% вода 11% хлорбензол 78,6%
64,79 °C (температура кипения азеотропа, давление 1 атм) бензол 62,4% вода 6,8% гептан 12,1% этиловый спирт 18,7%
108,584 °C (температура кипения азеотропа, давление 1 атм) вода 79,778% хлороводород 20,222%
203 °C (температура кипения азеотропа, давление 1 атм) вода 28,4% хлорная кислота 71,6%
111,35 °C (температура кипения азеотропа, давление 1 атм) вода 64,4% фтороводород 35,6%
127 °C (температура кипения азеотропа, давление 1 атм) вода 43% иодоводород 57%
120,7 °C (температура кипения азеотропа, давление 1 атм) азотная кислота 13,4% вода 86,6%
330 °C (температура кипения азеотропа, давление 1 атм) вода 1,7% серная кислота 98,3%
120 °C (температура кипения азеотропа, давление 1 атм) вода 32,3% гидразин 67,7%
83,59 °C (температура кипения азеотропа, давление 1 атм) вода 23,6% нитрометан 76,4%
88,89 °C (температура кипения азеотропа, давление 1 атм) аллиловый спирт 72,3% вода 27,7%
91,63 °C (температура кипения азеотропа, давление 1 атм) 1-нитропропан 63,5% вода 36,5%
88,55 °C (температура кипения азеотропа, давление 1 атм) 2-нитропропан 70,6% вода 29,4%
87,65 °C (температура кипения азеотропа, давление 1 атм) вода 28,3% н-пропиловый спирт 71,7%
66 °C (температура кипения азеотропа, давление 1 атм) вода 4,1% тетрахлорметан 95,9%
43,6 °C (температура кипения азеотропа, давление 1 атм) вода 2% сероуглерод 98%
56,2 °C (температура кипения азеотропа, давление 1 атм) вода 2,6% хлороформ 97,4%
38,1 °C (температура кипения азеотропа, давление 1 атм) вода 1,5% дихлорметан 98,5%
107,65 °C (температура кипения азеотропа, давление 1 атм) вода 25,5% муравьиная кислота 74,5%
87,22 °C (температура кипения азеотропа, давление 1 атм) вода 28,5% нитроэтан 71,5%
74,35 °C (температура кипения азеотропа, давление 1 атм) вода 22% этилнитрат 78%
78,174 °C (температура кипения азеотропа, давление 1 атм) вода 4% этиловый спирт 96%
98,6 °C (температура кипения азеотропа, давление 1 атм) вода 73% диметилсульфат 27%
119 °C (температура кипения азеотропа, давление 1 атм) вода 18,4% этилендиамин 81,6%
52,4 °C (температура кипения азеотропа, давление 1 атм) акролеин 97,4% вода 2,6%
-74,7 °C (температура плавления эвтектической смеси) вода 77% хлороводород 23%
104 °C (температура кипения азеотропа, давление 1 атм) вода 20% трифторуксусная кислота 80%
98 °C (температура кипения азеотропа, давление 1 атм) вода 72% перфтормасляная кислота 28%
Растворимость (в г/100 г или характеристика):
1,2-дихлорэтан: 0,187 (25°C)вода: смешивается
диэтиловый эфир: мало растворим
тетрахлорметан: 0,0116 (25°C)
хлороформ: 0,0932 (25°C)
этанол: смешивается
Вкус, запах, гигроскопичность:
вкус: без вкусазапах: без запаха
Дополнительное описание:
Криоскопическая константа = 1,86Способы получения:
1. Очистка природной воды.2. Сжигание водорода в кислороде или в воздухе.
Природные и антропогенные источники:
Одно из самых распространенных на Земле веществ. Количество воды на поверхности Земли оценивается в 1 390 000 000 000 000 000 т, большая часть из которых находится в морях и океанах. Количество доступной для использования пресной воды в реках, озерах, болотах и водохранилищах составляет 200 000 000 000 000 т. Масса ледников Антпрктики, Антарктиды и высокогорных районов оценивается в 24 000 000 000 000 000 т., примерно столько же имеется подземных вод, причем только небольшая часть из них - пресные. Вода входит в состав многих минералов и горных пород, присутствует в почве, является компонентом всех живых организмов.Плотность:
1 (4°C, г/см3)0,9971 (25°C, г/см3)
Показатель преломления (для D-линии натрия):
1,33369 (0°C)1,33369 (10°C)
1,33299 (20°C)
1,3325 (25°C)
1,33194 (50°C)
1,32725 (60°C)
Давление паров (в мм.рт.ст.):
1 (-17,4°C)10 (11,2°C)
100 (51,6°C)
Показатель диссоциации:
pKa (1) = 15,7 (20 C, вода)Диэлектрическая проницаемость:
78,3 (25°C)Дипольный момент молекулы (в дебаях):
1,84 (20°C)Динамическая вязкость жидкостей и газов (в мПа·с):
1,792 (0°C)1,308 (10°C)
1,005 (20°C)
0,894 (25°C)
0,801 (30°C)
0,656 (40°C)
0,549 (50°C)
0,469 (60°C)
0,406 (70°C)
0,3565 (80°C)
0,3165 (90°C)
0,284 (100°C)
0,26 (107°C)
0,22 (127°C)
0,18 (147°C)
0,16 (167°C)
0,14 (187°C)
0,13 (207°C)
0,12 (227°C)
0,11 (247°C)
0,1 (267°C)
0,094 (287°C)
0,086 (307°C)
0,079 (327°C)
0,071 (347°C)
0,042 (374°C)
Поверхностное натяжение (в мН/м):
75,62 (0°C)74,2 (10°C)
72,75 (20°C)
71,15 (30°C)
69,55 (40°C)
67,9 (50°C)
66,17 (60°C)
64,41 (70°C)
62,6 (80°C)
60,74 (90°C)
58,84 (100°C)
56,97 (110°C)
54,96 (120°C)
52,9 (130°C)
52,79 (140°C)
48,68 (150°C)
46,51 (160°C)
44,38 (170°C)
42,19 (180°C)
40 (190°C)
37,77 (200°C)
35,51 (210°C)
33,21 (220°C)
30,88 (230°C)
28,52 (240°C)
26,13 (250°C)
23,73 (260°C)
21,33 (270°C)
18,94 (280°C)
16,6 (290°C)
14,29 (300°C)
12,04 (310°C)
9,84 (320°C)
7,69 (330°C)
5,61 (340°C)
3,64 (350°C)
2,71 (355°C)
1,85 (360°C)
1,68 (361°C)
1,53 (362°C)
1,07 (365°C)
0,42 (370°C)
0,31 (371°C)
0,2 (372°C)
0,1 (373°C)
0 (374,15°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-285,83 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-237,24 (ж)Стандартная энтропия образования S (298 К, Дж/моль·K):
70,08 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
75,299 (ж)Энтальпия плавления ΔHпл (кДж/моль):
6,009Энтальпия кипения ΔHкип (кДж/моль):
40,66Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-241,82 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-228,61 (г)Стандартная энтропия образования S (298 К, Дж/моль·K):
188,72 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
33,58 (г)Критическая температура (в °C):
374,15Критическое давление (в МПа):
22,12Критическая плотность (в г/см3):
0,32Применение:
Во всех областях человеческой деятельности.
Дополнительная информация:
Длина связи O-H 0,0957 нм, валентный угол H-O-H 104,5 градусов, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. Электрическое сопротивление льда при 0 С = 0,4 мкОм.м, жидкой воды при 0 С = 1,47 мкОм·м, жидкой воды при 50 С = 18,9 мкОм·м. Коэффициент диффузии паров в воздухе = 0,216*(T/273)1,8 см2/с (T=273-1493 К).
- "Справочник химика" т.3, Л.-М.: Химия, 1965 стр. 907
- "Физические величины" под ред. Григорьева И.С., Мейлихова Е.З., М.:Энергоатомиздат 1991 стр. 332, 370
- "Химическая энциклопедия" т.1 М.: Советская энциклопедия, 1988 стр. 394-397
- Гордон А., Форд Р. "Спутник химика" М.: Мир, 1976 стр. 462
- Девяткин В.В., Ляхова Ю.М. "Химия для любознательных, или о чем не узнаешь на уроке" Ярославль:Академия Холдинг, 2000 стр. 46
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 59
Источники информации:
Синонимы/примеры:*
Дигидрогена монооксид; Оксид водорода
*подобраны ИИ, возможны неточности
Ещё по теме
Вода — строение, свойства и роль в природе
Вода
Экологическая химия гидросферы
Тяжёлая вода — свойства и применение
Вода как растворитель — уникальные свойства и роль в природе
Водород — свойства и способы получения
Водород — свойства, получение и применение
