Хлороформ
ХЛОРОФОРМ (трихлорметан, фреон 20, хладон 20) СНС13, мол. м. 119,38; бесцв. жидкость со сладковатым запахом; т. пл. -63,5 °С, т. кип. 61,1 °С;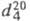 1,4832; плотн. по воздуху 4,1;
1,4832; плотн. по воздуху 4,1;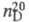 1,4459; длины связей 0,1073 нм (С—Н), 0,1767 нм (С—С); энергии связей 389,11 (С—Н) и 298,74 кДж/моль (С—С1);
1,4459; длины связей 0,1073 нм (С—Н), 0,1767 нм (С—С); энергии связей 389,11 (С—Н) и 298,74 кДж/моль (С—С1);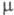 3,17 х 10-30 Кл х м;
3,17 х 10-30 Кл х м;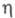 (мПа х с) жидкости 1,150 (-40 °С), 0,567 (20 °С), 0,409 (60 °С),
(мПа х с) жидкости 1,150 (-40 °С), 0,567 (20 °С), 0,409 (60 °С),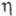 пара 10,0 (20 °С), 12,5 (100 °С), 22,1 (400 °С);
пара 10,0 (20 °С), 12,5 (100 °С), 22,1 (400 °С);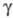 (мН/м) 38,1 (-60 °С), 27,1 (20 °С), 17,0 (100 °С), 0 (260 оС); tкрит 263,4 °С, ркрит 5,35 МПа, dкрит0,5 г/см3; давление пара (кПа) 0,11 (-60 оС), 2,48 (-20 °С), 8,0(0 °С), 20,7 (20 оС), 311 (100 °С), 1656(180 °С), 5001 (254 °С); Ср [кДж/(кг х К)] жидкости 0,808 (-60 °С), 0,950 (20 °С), 1,051 (100 °С), пара 0,519 (0 °С), 0,607 (100 °С), 0,762 (500 °С):
(мН/м) 38,1 (-60 °С), 27,1 (20 °С), 17,0 (100 °С), 0 (260 оС); tкрит 263,4 °С, ркрит 5,35 МПа, dкрит0,5 г/см3; давление пара (кПа) 0,11 (-60 оС), 2,48 (-20 °С), 8,0(0 °С), 20,7 (20 оС), 311 (100 °С), 1656(180 °С), 5001 (254 °С); Ср [кДж/(кг х К)] жидкости 0,808 (-60 °С), 0,950 (20 °С), 1,051 (100 °С), пара 0,519 (0 °С), 0,607 (100 °С), 0,762 (500 °С):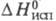 (кДж/кг) 267,9 (20 °С), 228,6 (100 °С), 134,8 (220 °С);
(кДж/кг) 267,9 (20 °С), 228,6 (100 °С), 134,8 (220 °С);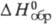 -100,48 кДж/моль;
-100,48 кДж/моль;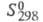 295,84 Дж/(моль х К); коэф. теплопроводности [Вт(м х К)] жидкости 0,1187 (20 °С), 0,0967 (100 °С), пара 0,00976 (100 °С), 0,01824 (300 °С);
295,84 Дж/(моль х К); коэф. теплопроводности [Вт(м х К)] жидкости 0,1187 (20 °С), 0,0967 (100 °С), пара 0,00976 (100 °С), 0,01824 (300 °С);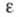 жидкости 4,796 (20 °С), пара 1,0087 (100 °С). Хорошо раств. в орг. р-рителях; р-римость в воде (% по массе) 0,482 (15 °С), 0,130 (60 °С), р-римость воды в хлороформе 0,006 (-25 °С), 0,065 (22 °С), 0,166 (51 °С); образует азеотропную смесь с водой (т. кип. 56,2 °С, 97,4% хлороформа).
жидкости 4,796 (20 °С), пара 1,0087 (100 °С). Хорошо раств. в орг. р-рителях; р-римость в воде (% по массе) 0,482 (15 °С), 0,130 (60 °С), р-римость воды в хлороформе 0,006 (-25 °С), 0,065 (22 °С), 0,166 (51 °С); образует азеотропную смесь с водой (т. кип. 56,2 °С, 97,4% хлороформа).
Хлороформ реагирует с хлором в жидкой фазе в присут. инициаторов или в паровой фазе (катализатор - активир. уголь) с образованием СС14. С бромом при 250 °С дает бромхлорметаны, с HF в присут. SbCl5 - трифторметан. При нагр. с водой разлагается до НСООН, СО и НС1. С разбавл. р-рами NaOH или КОН образуется HCOONa (или НСООК), при действии концентрир. щелочей разлагается до хлоридов металлов и СО. В присут. металлов VIII гр. гидрируется до метана. На свету медленно окисляется кислородом воздуха: ЗСНС13 + 3О2 СОС12 + ЗС12 + 2СО2 + НС1 + Н2О.
СОС12 + ЗС12 + 2СО2 + НС1 + Н2О.
 гидроксиальдегиды (Раймера - Тимана реакция). В газовой фазе реагирует с NO2 по схеме: СНС13 + NO2
гидроксиальдегиды (Раймера - Тимана реакция). В газовой фазе реагирует с NO2 по схеме: СНС13 + NO2 COC12 + NO + HC1; при т-ре выше 450 °С пиролизуется с образованием тетрахлорэтилена и НС1. При сольволизе (в присут. оснований) или термолизе образует дихлоркарбены (см. Карбены).
COC12 + NO + HC1; при т-ре выше 450 °С пиролизуется с образованием тетрахлорэтилена и НС1. При сольволизе (в присут. оснований) или термолизе образует дихлоркарбены (см. Карбены). Хлороформ получают совместно с метиленхлоридом хлорированием метана в паровой фазе при 510-520 °С и соотношении метан: хлор (4-5):1. Непрореагировавший метан и образовавшийся СН2С12 после отмывки от НС1, осушки, нейтрализации и компримирования реакц. газа возвращаются в реактор. Хлороформ, выделяемый ректификацией, имеет чистоту не менее 99,96%.
Хлороформ получают также газофазным хлорированием СН2С12 в объеме или в присут. катализатора (А12О3, песок и др.) либо жидкофазным хлорированием при 80-90 °С и давлении до 1 МПа в присут. N,N '-азо-бмс-изобутиронитрила. Хлороформ может быть получен (совместно с СН2С12 и СС14) окислит. хлорированием метана при 350-400 °С в присут. СuС12 + КС1, нанесенных на носитель (корунд, силикагель и др.), взаимод. хлораля или гексахлорацетона с Са(ОН)2 (метод потерял пром. значение из-за относительно высокой стоимости сырья и образования большого кол-ва отходов).
Используют хлороформ гл. обр. для произ-ва хладона 22, а также как р-ритель, хладагент, в синтезе лек. препаратов. Ранее применялся в медицине как средство для наркоза.
Хлороформ- негорюч; оказывает токсич. действие на внутр. органы, особенно на печень. ПДК в воздухе рабочей зоны 20 мг/м3. Производство хлороформа в США 238 тыс. т в год (1988).
Лит.: Промышленные хлорорганические продукты. Справочник, под ред. Л. А. Ошина, М., 1978, с. 26-35.
Ю. А. Трегер.
