Ацетон
АЦЕТОН (от лат. acetum - уксус) (2-пропанон, диметилкетон) СН3СОСН3, мол. м. 58,079; летучая бесцв. жидкость с характерным запахом; т. пл. — 94,6°С, т. кип. 56,1 °С; d420 0,7920, nD20 1,3588;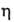 0,36 мПа*с (10°С), 0,30 мПа*с (30 С);
0,36 мПа*с (10°С), 0,30 мПа*с (30 С);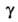 0,0237 Н/м (20°С); tкрит 235,5°С, pкрит 4,75 МПа; С°р 749,3 Дж/(кмоль*К);
0,0237 Н/м (20°С); tкрит 235,5°С, pкрит 4,75 МПа; С°р 749,3 Дж/(кмоль*К);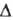 H°исп 29,1 кДж/моль (56,1 °С),
H°исп 29,1 кДж/моль (56,1 °С), Н°сгор -1787кДж/моль,
Н°сгор -1787кДж/моль,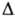 Н°обр - 216,5 кДж/моль (газ; 25°С) и — 248 кДж/моль (жидкость). Смешивается с водой и орг. р-рителями, напр. эфиром, метанолом, этанолом, сложными эфирами.
Н°обр - 216,5 кДж/моль (газ; 25°С) и — 248 кДж/моль (жидкость). Смешивается с водой и орг. р-рителями, напр. эфиром, метанолом, этанолом, сложными эфирами.
Ацетон обладает всеми хим. св-вами, характерными для алифатич. кетонов. Образует кристаллич. соед. с гидросульфитами щелочных металлов, напр. с NaHSO3 - (CH3)2C(OH)SO3Na. Только сильные окислители, напр. щелочной р-р КМnО4 и хромовая к-та, окисляют ацетон до уксусной и муравьиной к-т и далее - до СО2 и воды. Каталитически восстанавливается до изопропанола, амальгамами Mg или Zn, а также Zn с СН3СООН - до пинакона (СН3)2С(ОН)С(ОН)(СН3)2. Атомы водорода легко замещаются при галогенировании, нитрозировании и т.п. Действием хлора и щелочи ацетон превращ. в хлороформ, к-рый взаимод. с ацетоном с образованием хлорэтона (СН3)2С(ОН)СС13, применяемого как антисептик. Ацетон окисляет вторичные спирты в присут. алкоголятов А1 до кетонов (р-ция Оппенауэра):
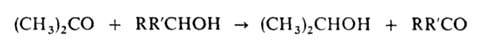
Вступает в альдольную конденсацию с образованием диацетонового спирта (СН3)2С(ОН)СН2СОСН3, а также в кротоновую конденсацию с образованием окиси мезитила (СН3)2С=СНСОСН3,форона(СН3)2С=-СНСОСН=С(СН3)2 и мезитилена. В присут. сильной минер. к-ты ацетон алкилирует фенол с образованием дифенилолпропана (бисфенола ацетона) (НОС6Н4)2С(СН3)2, присоединяет цианид-ион с образованием ацетонциангидрина (CH3)2C(OH)CN. При пиролизе (700°С) ацетона образуются кетен СН2—С—О и метан.
В пром-сти ацетон получают преим. т. наз. кумольным способом одновременно с фенолом из бензола и пропилена через изопропилбензол (кумол) по схеме: 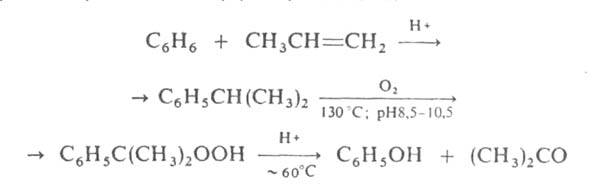
В ряде других пром. способов синтеза ацетона исходят из изопропанола:
1. Окисление в паровой фазе (кат. - металлич. Си, Ag, Ni или Pt): 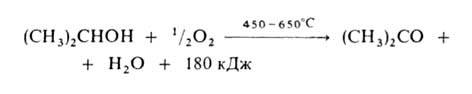
Высокий выход ацетона (ок. 90%) достигается при использовании Ag, осажденного на пемзе, или серебряной сетки.
2. Автокаталитич. окисление в жидкой фазе при 90-140°С и 0,2-0,3 МПа: 
Выход ацетона 95% от теоретического, Н2О2 87%.
3. Дегидрирование в паровой фазе в присут. ZnO, осажденной на пемзе: 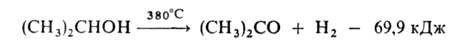
Степень превращ. изопропанола в ацетон при 225 °С составляет 84% при 380°С - 98%, при 525°С - 100%. Выход ацетона около 90%.
Новый пром. способ получения ацетона - прямое окисление пропилена в жидкой фазе в присут. PdCl2 в среде водного р-ра солей Pd, Fe или Си при 50-120 °С и 5-10 МПа:
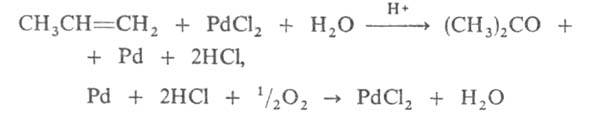
Выход ацетона 90%. Нек-рое значение сохранил способ получения ацетона брожением крахмала под влиянием бактерий Bacyllus acetobutylicus, превращающих крахмал в ацетон и бутанол (т. наз. ацетоновое брожение). Известны и др. способы получения:
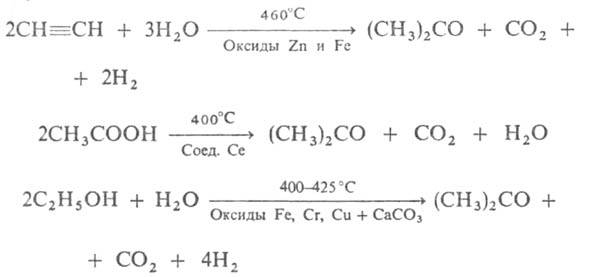
Старый пром. метод получения ацетона-сухая перегонка (СН3СОО)2Са - потерял значение.
Для качеств. определения ацетона используют цветные р-ции, напр. с динитробензолом, нитропруссидом Na (реактив Легаля); для идентификации - кристаллич. производные ацетона, напр. семикарбазон (т. пл. 187°С). Количественно ацетон определяют: 1) оксимированием:
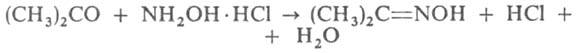
образующийся НCl титруют щелочью; 2) титрованием р-ром КМnО4 в щелочной среде (при этом ацетон окисляется до СО2 и Н2О).
Ацетон - широко применяемый р-ритель орг. в-в, в первую очередь нитратов и ацетатов целлюлозы; благодаря сравнительно малой токсичности он используется также в пищ. и фармацевтич. пром-сти; ацетон служит также сырьем для синтеза уксусного ангидрида, кетена, диацетонового спирта, окиси, мезитила, метилизобутилкетона, метилметакрилата, дифенилолпропана, изофорона и многих др. соединений. Мировое произ-во ацетона ок. 3 млн. т/год (1980).
Для ацетона т. всп. -20°С, т. самовоспл. 500°С; КПВ 2,15-13,00%. Ацетон при вдыхании накапливается в организме. Т.к. выводится из организма медленно, возможны хронич. отравления. ПДК 200 мг/м3.
Литература
Кружалов Б. Д., Голованенко Б. И., Совместное получение фенола и ацетона, М, 1963; Теддер Дж., Нехватал А., Джубб А., Промышленная органическая химия, пер. с англ., М., 1977; Kirk-Othmer encyclopedia, 3 ed., v. 1. N.Y.. 1978, p. 179-91. Ю.Н.Юрьев.
