Этилацетат
ЭТИЛАЦЕТАТ (этиловый эфир уксусной к-ты) CH3COOC2H5; мол. м. 88,11; бесцв. жидкость с приятным запахом; т. пл. -84 °С, т. кип. 77,1 °С;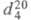 0,9001;
0,9001; 1,3724; tкрит 250,4 oС, Ркрит3,78 МПа;
1,3724; tкрит 250,4 oС, Ркрит3,78 МПа;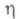 0,455 мПа x с (20 °С);
0,455 мПа x с (20 °С);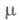 6,03 x 10-30 Кл x м;
6,03 x 10-30 Кл x м;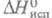 34,75 Дж/моль,
34,75 Дж/моль,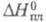 10,481 Дж/моль;
10,481 Дж/моль;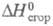 -2254,98 кДж/моль,
-2254,98 кДж/моль,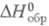 -463,8 кДж/моль;
-463,8 кДж/моль;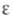 6,053; смешивается с этанолом, диэтиловым эфиром, бензолом, СНС13; р-римость (% по массе): в воде 12, воды в этилацетате 9,7. Этилацетат образует двойные азеотропные смеси с водой (т. кип. 70,4 °С, содержание воды 8,2% по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), ССl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь этилацетат: вода:этанол (т. кип. 70,3 °С, содержание соотв. 83,2, 7,8 и 9% по массе).
6,053; смешивается с этанолом, диэтиловым эфиром, бензолом, СНС13; р-римость (% по массе): в воде 12, воды в этилацетате 9,7. Этилацетат образует двойные азеотропные смеси с водой (т. кип. 70,4 °С, содержание воды 8,2% по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), ССl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь этилацетат: вода:этанол (т. кип. 70,3 °С, содержание соотв. 83,2, 7,8 и 9% по массе).
Этилацетат обладает всеми св-вами эфиров сложных.
В пром-сти этилацетат получают: 1) по Тищенко реакции из ацетальдегида при 0-5 °С в присут. каталитич. количеств алкоголята Аl; конверсия ацетальдегида 98%, селективность 97-98%; 2) этерификацией СН3СООН этанолом при 110-115 °С в присут. H2SO4, соотношение к-ты и спирта (1:1,1), степень конверсии более 95%; 3) взаимод. СН3СООН с этиленом при т-ре 150 °С и давлении 7,7 МПа в присут. H2SO4 при соотношении СН3СООН: этилен 1:3,89.
Лаб. способы получения: взаимод. С2H5ОН с СН3СОС1, кетеном либо (СН3СО)2О, или р-цией СО с СН3ОН и этиленом.
Этилацетат- р-ритель нитроцеллюлозы, ацетилцеллюлозы, смоляных масляных лаков, жиров, восков, в смеси со спиртом -р-ритель в произ-ве искусств. кожи. Применяется как экстрагент орг. соед. из водных р-ров, желатинизирующее средство в произ-ве взрывчатых в-в, компонент фруктовых эссенций.
Пары этилацетаты раздражают слизистые оболочки глаз и дыхат. путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м3.
Т. всп. 2 °С, т. воспл. ниже О °С, т. самовоспл. 400 °С, КПВ паров в воздухе 2,1-16,8% (по объему), температурные пределы воспламенения 1-31 °С.
Мировой объем произ-ва этилацетата 0,45-0,5 млн. т в год (1986), в т.ч. в Японии 0,11, Германии 0,08, США 0,08.
Лит.: Рид Р., Праусниц Дж., Шервуд Т., Свойства газов и жидкостей, пер. с англ., Л., 1982; Kirk-Othmer encyclopedia, 3 ed., v. 21, N. Y., 1983, p. 382-83.
3. П. Присяжнюк.
