Ацетон
Ацетон, диметилкетон, CH3COCH3, простейший кетон, бесцветная жидкость с характерным запахом; температура кипения 56,2°С, температура плавления —94,9°С, плотность 790,8 кг/м3, смешивается во всех отношениях с водой, спиртом, эфиром.
Ацетон обладает типичными химическими свойствами кетонов. Так, он образует 2,4-динитрофенилгидразон, оксинитрил; последний используют для получения одного из видов оргстекла — полиметилметакрилата. Ацетон присоединяет хлороформ с образованием антисептика хлорэтона (CH3)2C(OH)CCl3. При нагревании ( ~ 700°С) ацетон превращается в кетен CH2 = C = O. Действием хлора и щёлочи на ацетон можно получить хлороформ CHCl3. Ацетон — реакционноспособное соединение, он может вступать во многие химические реакции, среди которых немало важных в промышленном отношении. Первоначально ацетон получали нагреванием уксуснокислого кальция: (CH3COO)2Ca ® CH3COCH3 + CaCO3, или пропусканием паров уксусной кислоты над окисью церия, титана и другими катализаторами. Сохранил ещё некоторое значение способ получения ацетона из крахмала под влиянием особых бактерий (ацетоновое брожение). Основным методом получения ацетона является гидратация пропилена с последующим окислением промежуточно образующегося изопропилового спирта:
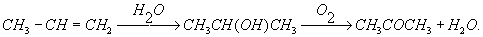
Значительный практический интерес имеет также способ одновременного получения ацетона и фенола из изопропилбензола (кумола), который окисляется кислородом воздуха в гидроперекись, расщепляющуюся на фенол и ацетон:
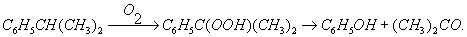
Ацетон широко применяется как растворитель (особенно для нитро- и ацетилцеллюлозы) и как исходный продукт в производстве кетена, йодоформа, изопрена, эфиров метакриловой кислоты и т. д.
Лит.: Бочков А. Ф., Ацетон, в кн.: Краткая химическая энциклопедия, т. 1, М., 1961.
Я. Ф. Комиссаров.
