Ацетоуксусный эфир
АЦЕТОУКСУСНЫЙ ЭФИР (этиловый эфир ацетоуксусной к-ты, этилацетоацетат), мол. м. 130,1418; бесцв. жидкость; т. пл. -45°С, т. кип. 180,8°С (с разл.), 100°С/80 мм рт. ст., 71°С/12,5мм рт.ст.; d420 1,0284, nD20 1,4198; раств. в воде (14,3% при 16,5°С), этаноле, эфире. Существует в двух таутомерных формах - кетонной (а)и енольной (б): 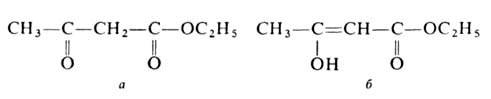
Енольная форма стабилизируется за счет сопряжения двойной углерод-углеродной связи с карбонильной группой и образования внутримолекулярной водородной связи между гидроксилом и карбонилом. Кетонную форму можно выделить вымораживанием, енольную - фракционной перегонкой в кварцевой посуде в вакууме; для них т. пл. соотв. -39 и -44°С, d420 1,0368 и 1,0119, nD20 1,4425 и 1,4480. Соотношение таутомеров зависит от природы р-рителя, материала сосуда, т-ры, напр. в ацетоуксусном эфире при комнатной т-ре содержится 7,5% енола, при 18°С в р-рах ацетоуксусног эфира в воде, этаноле, эфире и циклогексане - соотв. 0,4, 12, 27,1 и 46,4%. Чистые таутомерные формы сохраняются в кварцевой посуде при -80°С.
Под действием разб. р-ров к-т или щелочей ацетоуксусный эфир подвергается расщеплению с образованием ацетона (т. н. кетонное расщепление), под действием конц. р-ров щелочей - с образованием уксусной к-ты (кислотное расщепление): 
Как кетон ацетоуксусный эфир восстанавливается Н2 in situ до этил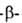 гидроксибутирата; присоединяет, напр., HCN, NaHSO3 с образованием соотв. циангидрина и гидросульфитного производного. Р-ция с фенилгидразином сопровождается циклизацией фенилгидразона ацетоуксусного эфира:
гидроксибутирата; присоединяет, напр., HCN, NaHSO3 с образованием соотв. циангидрина и гидросульфитного производного. Р-ция с фенилгидразином сопровождается циклизацией фенилгидразона ацетоуксусного эфира:
Как енол ацетоуксусный эфир мгновенно обесцвечивает р-р Вг2 (р-ция служит для количеств. определения енола), с Fed, образует комплекс красно-фиолетового цвета, с РС15- хлоркротоновый эфир СН3СС1=СНСООС2Н5. Ацетилируется хлорангидридами к-т:
хлоркротоновый эфир СН3СС1=СНСООС2Н5. Ацетилируется хлорангидридами к-т: 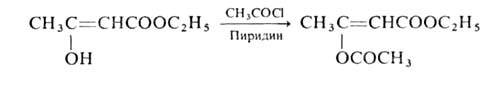
При действии на ацетоуксусный эфир металлич. Na или алкоголятов Na в спиртовом р-ре получается натрийацетоуксусный эфир CH3C(ONa)—СНСООС2Н5, широко используемый в р-циях с алкилгалогенидами, приводящих к образованию алкил- и диалкилацетоуксусных эфиров-соответственно CH3COCH(R)COOC2H5 и CH3COC(RR')COOC2H5. Кетонное и кислотное расщепление последних происходит так же, как и ацетоуксусного эфира. Напр., при кетонном расщеплении метилацетоуксусного эфира получается метилэтилкетон, при кислотном - уксусная и пропионовая к-ты. В зависимости от характера реагента, природы р-рителя и условий из натрийацетоуксусного эфира могут получаться как С-, так и О-производные ацетоуксусного эфира.
Атомы Н метиленовой группы ацетоуксусного эфира очень подвижны, благодаря чему он реагирует, напр., с альдегидами:
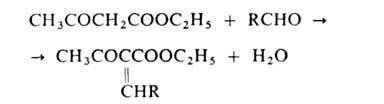
вступает в р-цию Михаэля и др. В пром-сти и лаборатории ацетоуксусный эфир получают действием металлич. Na на этилацетат (см. Клайзена конденсация]. Образующийся натрийацетоуксусный эфир действием разб. минер. к-т переводят в ацетоуксусный эфир. Применяют ацетоуксусный эфир в синтезе лек. ср-в (напр., амидопирина, антипирина, акрихина), витамина В1, красителей, содержащих пиразолоновый цикл; как ароматизирующее в-во для пищ. продуктов. Ацетоуксусный эфир раздражает кожу. Т. всп. 85оС.
Литература
Ингольд К., Теоретические основы органической химии, пер. с англ., 2 изд., М., 1973, с. 657-736; Несмея но в А. Н., Несмеянов Н. А., Начала органической химии, кн. 1, М., 1974; Роберте Д. Д., Кассерио М. К., Основы органической химии, пер. с англ., т. 1, М., 1978. Ф.А. Чернышкова.
