Кетоны
Кетоны, класс органических соединений, содержащих карбонильную группу 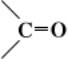 , связанную с двумя органическими радикалами, RCORў. В зависимости от природы R и R’ различают кетоны алифатического (жирного), алициклического, ароматического или гетероциклического ряда. Так, простейший кетон жирного ряда — ацетон (диметилкетон) СН3СОСН3, ароматического ряда — бензофенон С6Н5СОС6Н5. В отличие от приведённых симметричных, существуют и несимметричные (смешанные) кетоны, содержащие разные радикалы R и R’, например жирноароматические кетоны — ацетофенон С6Н5СОСН3. Известны также многочисленные циклические кетоны, у которых группа CO входит в цикл, например циклогексанон
, связанную с двумя органическими радикалами, RCORў. В зависимости от природы R и R’ различают кетоны алифатического (жирного), алициклического, ароматического или гетероциклического ряда. Так, простейший кетон жирного ряда — ацетон (диметилкетон) СН3СОСН3, ароматического ряда — бензофенон С6Н5СОС6Н5. В отличие от приведённых симметричных, существуют и несимметричные (смешанные) кетоны, содержащие разные радикалы R и R’, например жирноароматические кетоны — ацетофенон С6Н5СОСН3. Известны также многочисленные циклические кетоны, у которых группа CO входит в цикл, например циклогексанон
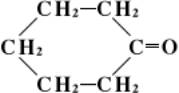
Наименования кетонов жирного ряда по Женевской номенклатуре производят от названия соответствующих углеводородов, прибавляя окончание «он» и указывая место карбонильной группы; так, диэтилкетон CH3CH2COCH2CH3 называют пентанон-3.
Низшие алифатические кетоны — бесцветные жидкости с приятным запахом, смешивающиеся с водой; высшие — твёрдые вещества. Все кетоны растворимы в органических растворителях.
По способам получения и свойствам кетоны аналогичны альдегидам; однако кетоны менее реакционноспособны, значительно более устойчивы к окислению. Для кетонов характерны два вида реакций, обусловленных наличием карбонильной группы, — присоединение к карбонильной группе и замещение её атома кислорода. Так, к кетонам легко присоединяется синильная кислота HCN с образованием оксинитрилов RC (OH) RўCN; аналогично с кетонами реагируют бисульфит натрия NaHSO3, хлороформ CHCl3 и др. При гидрировании кетонов образуются вторичные спирты:
RCORў+H2 ® RCH (OH) Rў,
при взаимодействии кетонов с металлоорганическими соединениями и последующем гидролизе — третичные спирты:
RCOR’+R’’MgX ® RR’C(R’’)OmgX ® RR’R’’COH.
При взаимодействии с PCI5 атом кислорода в кетонах замещается на два атома хлора. С гидроксиламином кетоны дают кетоксимы:
RCOR’+NH2OH ® RC (=NOH) R’;
эту реакцию, а также образование др. кристаллических продуктов замещения кислорода (например, гидразонов, 2,4-динитро-фенилгидразонов) применяют для идентификации кетонов. Гидролиз этих продуктов используется для получения чистых кетонов. Большое значение имеет восстановление группы 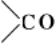 до
до 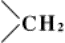 (Кижнера —Вольфа реакция).
(Кижнера —Вольфа реакция).
В промышленности кетоны получают дегидрированием вторичных спиртов:
RCH (OH) R’ ® RCOR’+H2
термическим разложением кальциевых солей карбоновых кислот:
(RCOO)2Ca ® R2CO+CaCO3
или пропусканием паров карбоновых кислот над катализаторами типа окисей тория, бария, а также карбоната кальция. Ароматические и жирноароматические кетоны получают при действии на ароматические углеводороды хлорангидридов кислот в присутствии хлористого алюминия, например:
C6H6+CH3COCl ® C6H5COCH3+HCl.
Многие кетоны можно получать окислением углеводородов кислородом воздуха в присутствии катализаторов: например, из этилбензола C6H5CH2CH3 получают ацетофенон, из циклогексана — циклогексанон.
Кетоны находят разнообразное применение. Так, циклогексанон служит исходным продуктом для получения синтетических волокна капрона. Михлера кетон применяют в производстве триарилметановых красителей. Некоторые кетоны используют в парфюмерии (см. Иононы).
Лит.: Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1—2, М., 1969—70.
