Кетены
Кетенами называются соединения, содержащие в молекуле группу >С=С=О. Кетены могут быть получены из галоидангидридов бромзамещенных кислот действием цинковой пыли (Штаудингер), например:
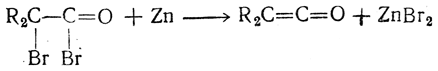
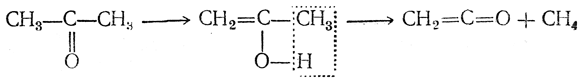
Простейший кетен СН2=С—О можно таким образом получить из бромангидрида бромуксусной кислоты. Он может быть также получен пиролизом ацетона при 500—600° С над глиноземом или на раскаленной электрическим током платиновой проволоке в специальном приборе, называемом кетенной лампой:
В технике кетен получают пиролизом ацетона или уксусной кислоты. Пиролиз уксусной кислоты проводится под действием гомогенных катализаторов (фосфорных или азотистых соединений) при 600—800° С:
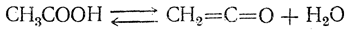
Чтобы воспрепятствовать обратной реакции, следует быстро охлаждать продукты реакции.
Кетены имеют резкий раздражающий запах, довольно токсичны. Они легко растворяются в органических растворителях, не содержащих в молекуле подвижного водорода.
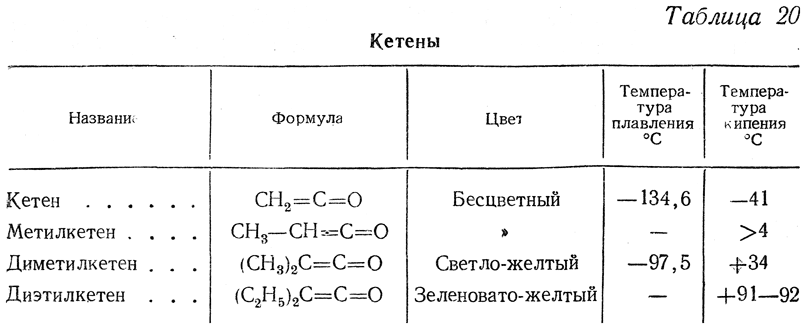
Физические свойства некоторых кетенов приведены в табл. 20.
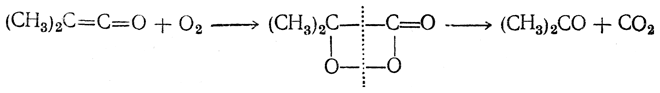
Кетены являются исключительно реакционноспособными соединениями. Они весьма легко подвергаются окислению; при низких температурах могут давать с кислородом нестойкие взрывчатые перекиси, например:
С водой, спиртами, кислотами, аминами и т. п. они чрезвычайно легко вступают в реакции типа
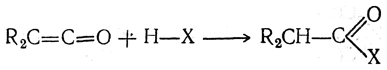
С магнийорганическими соединениями они реагируют с образованием смешанного алкоголята енольной формы кетона:
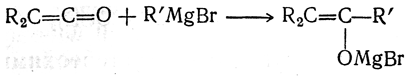
При действии воды получается кетон R2CH—СО—R'.
Кетены легко подвергаются полимеризации даже при 0° С; при более высокой температуре полимеризация происходит с возрастающей скоростью — вплоть до взрывной. Простейший кетен устойчив лишь при температурах ниже —80° С. Первоначальным продуктом полимеризации оказывается димер состава С4Н4О2, жидкость с относительной плотностью 1,090 (при 20° С), кипящая при 127,4° С. Пиролизом при 550— 600° С можно вновь получить мономерный кетен. Наиболее вероятным является следующее строение димера (так называемого дикетена)
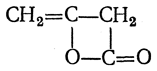
т. е. строение циклического внутреннего эфира — (β-лактона енольной формы ацетоуксусной кислоты. Димер способен превращаться далее в С6Н4О4— дегидрацетовую кислоту (производное пирона).
Кетен находит в настоящее время техническое применение для производства уксусного ангидрида
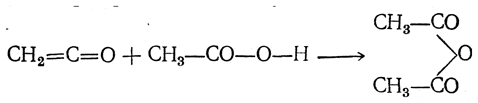
а также в ряде случаев для ацетилирования.
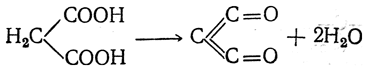
При нагревании малоновой кислоты с пятиокисью фосфора в вакууме можно, охлаждая образующиеся газы смесью твердой углекислоты с ацетоном, уловить своеобразный кетен, недокись углерода С3О2:
Она может быть также получена действием цинковой пыли на полный бромангидрид диброммалоновой кислоты:
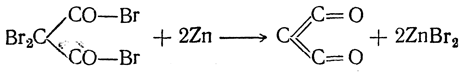
Недокись углерода — жидкость, кипящая около +7°, сильно раздражающая органы дыхания и зрения. Она реагирует аналогично кетенам, например с водой дает малоновую кислоту:
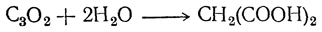
Установлено, что в согласии со стереохимической теорией молекула недокиси углерода имеет линейную конфигурацию:
О=С=С=С=О
Путем присоединения к простым виниловым эфирам брома, превращения полученного дибромида действием спирта в ацеталь бромуксусного альдегида и последующего отщепления водорода при действии изобутилата калия получается ацеталь кетена:
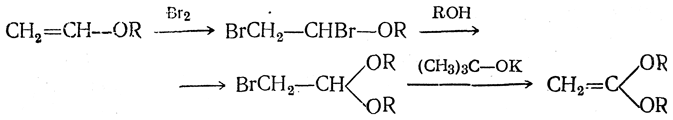
Существование описанного Шейблером (1925) ацеталя окиси углерода С(ОС4Н5)2 не подтвердилось (А. Е. Арбузов, Штаудингер и др.).


