Keтoальдегиды
KETOАЛЬДЕГИДЫ, дикарбонильные соед., содержащие в молекуле альдегидную и кетонную группы. В зависимости от числа атомов С между оксогруппами различают 1,2-кетоальдегиды (a-кетоальдегиды), 1,3-кетоальдегиды (b-кетоальдегиды), 1,4-кетоальдегиды (g-кетоальдегиды), 1,5-кетоальдегиды (d-кетоальдегиды), 1,6-кетоальдегиды (e-кетоальдегиды) и т.д. По номенклатуре ИЮПАК, назв. кетоальдегидов производят от назв. соответствующих альдегидов, прибавляя префикс "оксо", обозначающий наличие кетонной группы. Напр., соед. СН3СОСНО наз. 2-оксопропаналь, С6Н5СОСНО - 2-фенил-2-оксоэтаналь, СН3СОСН2СНО - 3-оксобутаналь; однако для этих альдегидов наиб. употребительны тривиальные назв.: соотв. метилглиоксаль (пировиноградный альдегид), фенилглиоксалъ и ацетоуксусный альдегид (формилацетон). Кетоальдегиды - жидкости или твердые в-ва, р-римые в воде и орг. р-рителях. В ИК спектрах кетоальдегидов наиб, важные характеристич. полосы поглощения: для a-кетоальдегидов - в области частот 1730-1710 см-1 (vC=O), для b-К - в области 1640-1540 см-1 (v=C-OH) и 1740-1720см-1 (vCH=O), для g-кетоальдегидов- в области 1725-1705 см-1.
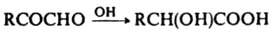
Метил- и фенилглиоксали вступают в р-цию типа бензоиновой конденсации:
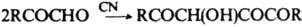 (где R=СН3, С6Н5). При взаимод. a-кетоальдегидов с 1,2-диаминами или амидинами образуются соотв. производные пиразина или имидазола:
(где R=СН3, С6Н5). При взаимод. a-кетоальдегидов с 1,2-диаминами или амидинами образуются соотв. производные пиразина или имидазола: 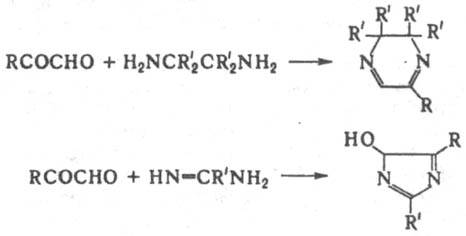
Для Р-кетоальдегидов RCOCR'R:CHO характерна высокая реакц. способность группы CH2(R', R:=Н), расположенной между оксогруппами, вследствие повыш. кислотности ее атомов Н. Поэтому Р-кетоальдегиды особенно склонны к замещению этих атомов и конденсации по группе СН2. Повыш. кислотностью b-кетоальдегидов обусловлена также их легкая енолизация. Незамещенные в a-положении b-кетоальдегиды существуют в осн. в форме b-гидроксиметиленкарбонильных соед. (см. Таутомерия):
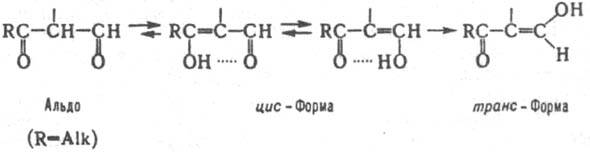
Они неустойчивы и очень легко тримеризуются с образованием производных бензола. Так, формилацетон СН3СОСН2СНО мгновенно превращ. в 1,3,5-триацетилбензол. С гидроксиламином Р-кетоальдегиды образуют производные изоксазола, а с гидразинами - производные пиразола:
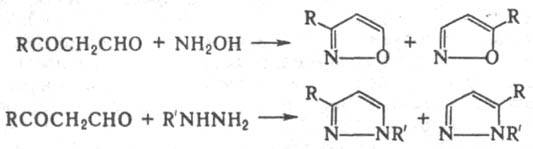
При взаимод. g-кетоальдегидов RCO(CR'R:)2CHO с фенилгидразином получают производные N-фенилдигидропиридазина:
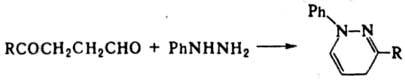
Под действием C2H5ONa d-кетоальдегиды легко изомеризуются в d-лактоны:
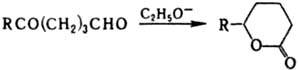
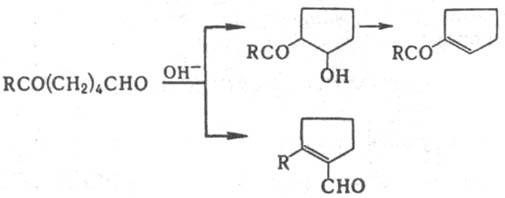
В присут. щелочи e-кетоальдегиды циклизуются в 2-ацилциклопентанолы, 1 -ацилциклопентены или в 2-алкил-1 -формилциклопентены, к-рые используются для синтеза простагландинов и терпеноидов:
О методах синтеза кетоальдегидов см. Дикарбонилъные соединения. Качеств, определение: водные р-ры кетоальдегидов восстанавливают реактив Фелинга и аммиачный р-р AgNO3. Для количеств, определения кетоальдегидов используют их производные по оксогруппам, напр. диоксимы, 2,4 - динитрофенилгидразоны. Метилглиоксаль используют в гистохимии ферментов (в фосфатном или какодиловом буферном р-ре) и в электронной микроскопии в качестве фиксатора ткани. Метилглиоксаль и моногидрат фенилглиоксаля (т. пл. 91 °С, т. кип. 97°С/125мм рт. ст.) - специфич. реагенты на аминокислоты, напр. глицин, аргинин. Оксим фенилглиоксаля (т. пл. 126-128 °С) - аналитич. реагент для обнаружения Со, Fe, Hg, Mn, Ni, Pb и Pd.
Литература
