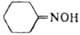
Оксимы
ОКСИМЫ, производные альдегидов или кетонов (соотв. альдоксимы RCH=NOH или кетоксимы RR'C=NOH, где R, R'-opr. радикалы). Оксимы-жидкости или низкоплавкие твердые в-ва (см. табл.), хорошо раств. во многих орг. р-рителях, плохо-в холодной воде. Оксимы альдегидов и несимметричных кетонов существуют в виде двух стереоизомерных форм, напр. для бензальдоксима син- (Е, ф-ла I) и анти- (Z, II), к-рые могут существенно различаться по св-вам. Взаимные превращ. стереоизомеров осуществляются при действии к-т или при облучении.

СВОЙСТВА НЕКОТОРЫХ ОКСИМОВ
| Соединение | Мол. м. | Т. пл., °С | Т.кип., °С | ||
| Формальдоксим CH2=NOH | 45,042 | _ | 84 | ||
| Ацетальдоксим CH3CH=NOH | 59,068 | 47 | 115 | ||
| Бензальдоксим C6H5CH=NOH | 121,134 | | | ||
| син- (Е) | | 36-7 | 200 | ||
| анти- (Z) | | 132 | | ||
| Глиоксим HON=CHCH=NOH | 88,072 | 178 (с разл.) | Возгоняется | ||
| Диметилглиоксим HON=C(CH3)C(CH3)=NOH | 116,124 | 246 | Возгоняется | ||
| Ацетоксим (CH3)2C=NOH | 121,134 | 61 | 134,8 | ||
| Циклогексаноноксим | 113,158 | 90 | 206-210 | ||
ИК спектры оксимов имеют 2 слабые полосы поглощения при 3650-3500 и 1690-1650 см -1, отвечающие валентным колебаниям О—Н и C=N связей соотв., и сильную полосу при 960-930 см -1 (валентные колебания N—О-связи).
Оксимы - слабые к-ты и очень слабые основания. При нагр. с водными р-рами к-т гидролизуются до RR'C=O и МН2ОН. Взаимодействие оксимов со щелочами или алкоголятами щелочных металлов приводит к солям RR'C=NOM, к-рые легко алкилируются с образованием О-алкильных производных; эти же производные получаются из О-алкилгидроксилами-нов и карбонильных соед., напр.:
RR'C=NONa + R:I 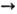 RR'C=NOR:
RR'C=NOR: 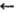 RR'CO + NH2OR:
RR'CO + NH2OR:
При алкилировании оксимов в отсутствие оснований образуются нитроны, при галогенировании - -галогеннитрозо-производные, при нитровании - псевдонитролы:
-галогеннитрозо-производные, при нитровании - псевдонитролы:
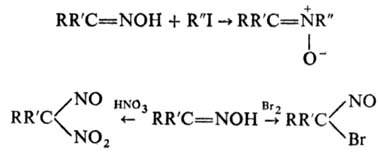
Кислотные агенты (полифосфорные к-ты, РCl5 хлоран-гидриды сульфокислот и др.) превращают кетоксимы и эфиры оксимов в амиды (см. Бекмана перегруппировка), а альдоксимы и оксимы 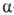 -гидроксикетонов - в нитрилы, напр.:
-гидроксикетонов - в нитрилы, напр.:
Оксимы вступают в р-ции присоединения по связи C=N: с HCN образуют гидроксиаминонитрилы RR'C(CN)NHOH, при восстановлении- N-алкилгидроксиламины и амины. Дегидрирование оксимов приводит к имтоксилъным радикалам RR'C=NO•.
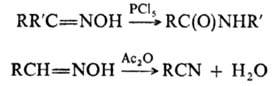
Получают оксимы обычно нагреванием карбонильного соед. с гидрохлоридом гидроксиламина в присут. эквивалентного кол-ва или избытка щелочи в водном или спиртовом р-ре; р-цию можно проводить в среде пиридина в отсутствие щелочи, а иногда и в кислой среде. Оксимы получают также нитрозированием нек-рых углеводородов или соед., содержащих активированную метиленовую или метильную группу, напр.:
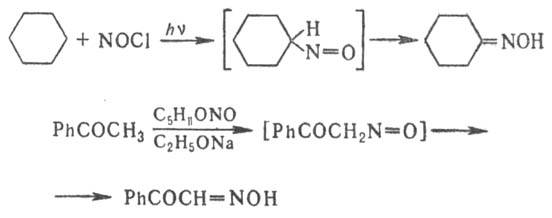
Иногда оксимы получают окислением первичных аминов или восстановлением нитросоед.:
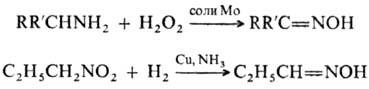
Образование оксимов используют для выделения, идентификации и количеств. определения карбонильных соединений. Нек-рые оксимы-аналит. реагенты, напр. диметилглиоксим применяют для разделения и концентрирования Ni (II), Pd(II) и Re (IV), 1,2-диоксимы-для определения Ni, Co, Сu и платиновых металлов, 2,2'-фурилдиоксим [1,2-(2-фурил)этандион-диоксим]-для определения Pd в рудах, формальдоксим-реагент для фотометрия, определения Mn(III), Ce(IV), V(V) в щелочной среде. Оксимы применяют для получения пестицидов (напр., бутокарбоксим, бутоксикарбоксим), лек. препаратов (напр., 2-пиридинальдоксимметиодид), циклогексаноноксим-в произ-ве капролактама.
Лит.: Вейганд К., Методы эксперимента в органической химии, пер. с нем., ч. 2, М., 1950, с. 288; Неницеску К. Д., Органическая химия, пер. с рум., т. 1, М., 1962; Органикум, пер. с нем., т. 2, М., 1979, с. 61. Л. Г. Менчиков.