Таутомерия
ТАУТОМЕРИЯ, изомерия, при к-рой происходит быстрое обратимое самопроизвольное взаимопревращение структурных изомеров-таутомеров. При установившемся равно-весии в-во содержит одновременно молекулы таутомеров в определенном соотношении. Процесс такою взаимопревращения таутомеров наз. таутомеризацией. Она протекает с обязательным разрывом одних хим. связей и образованием др. связей между атомами одной молекулы (внутримолекулярная таутомерия) или агрегата молекул (межмолекулярная таутомерия). В большинстве таутомерных систем процессы разрыва-образования связей можно представить как миграцию определенной атомной группы между двумя или неск. центрами в молекуле. Таутомеризация может происходить в результате миграции катионов (катионотропная таутомерия). Очень важной мигрирующей группой является протон, и потому главный вид таутомерии-прототропная таутомерия (прототропия, напр. ур-ние 1). Мигрирующими группами м. б. металлы (метал-лотропия, ур-ние 2), анионы (анионотропия, 3), ацильные группы (ацилотропия, 4) и др.
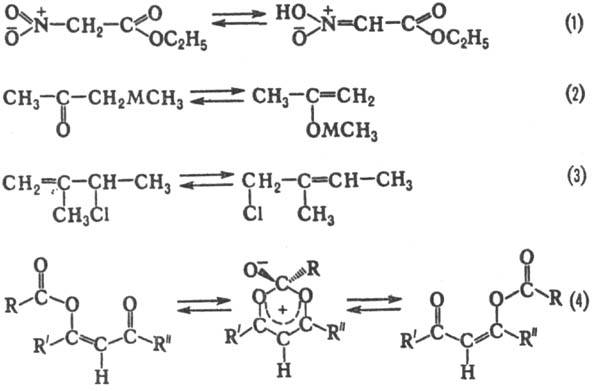 - i
- i
Характер таутомерного равновесия определяется кинетич. и термодинамич. факторами. При низких барьерах активации перенос протона происходит очень быстро. Напр., константы скорости переноса протона в цис-хелатных формах 1,3-дикетонов превышают 105-106с-1 (по данным ПМР) даже при достаточно низких т-рах и таутомерия становится вырожденной:
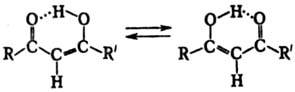
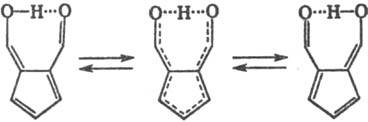
В молекуле 6-гидроксифульвен-1-карбальдегида процесс вырожденной таутомерии сводится к колебанию протона в мостике О???H???О:
При уменьшении кислотности системы, напр. для СН-кислот, перенос протона идет с относительно низкой скоростью. Так, время жизни енольной (а) и кетонной (б) форм ацетилацетона (кето-енольная таутомерия) составляет соотв. 14,2 и 3,8 с (по данным ПМР):
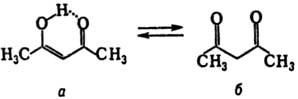
Для нек-рых 1,3-дикарбонильных соед. таутомерные превращения происходят со столь низкими скоростями, что таутомеры м.б. разделены при обычных т-рах, как, напр., ацетоуксусный эфир, к-рый в результате прототропии является смесью двух таутомеров-кетонной (а) и енольной (б)форм:
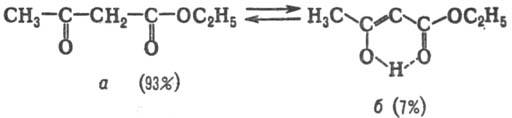
Увеличение СН-кислотности карбонильного соед. достигается введением в a-положение к карбонильной группе электроотрицат. заместителей, что, в свою очередь, приводит к значит. повышению содержания енола (см. табл.).

Кето-енольная таутомерия и, как следствие, двойственная реакц. способность (р-ции по атомам О или C) обусловливают широкие синтетич. возможности b-дикарбонильных соединений (см. Дикарбонилъные соединения).
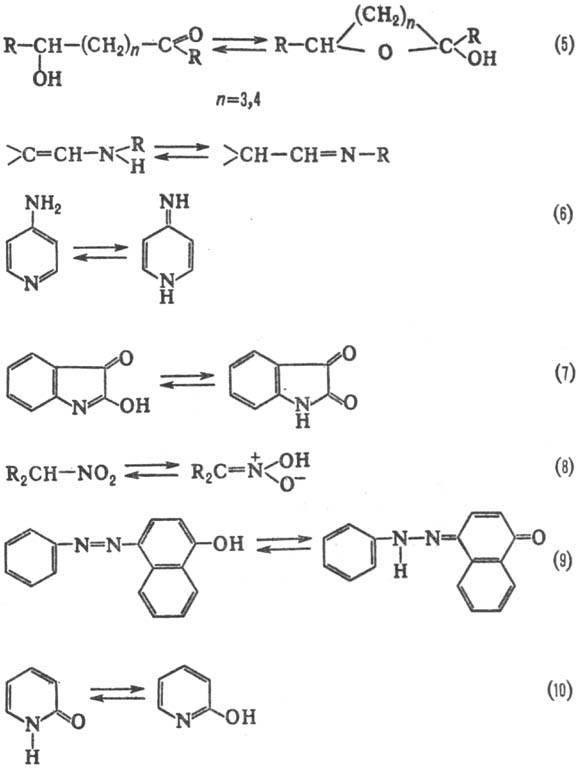
Др. примеры прототропной таутомерии: кольчато-цепная (5)-между ациклич. и циклич. формами 1,5- и 1,6-гидроксиальдегидов (или гидроксикетонов), см. также Мутаротация; амино-енаминная (6); лактим-лактамная (7); аци-нитротаутомерия (8); азофенол-хинонгидра-зонная (9); таутомерия гетероциклич. систем, напр. 2- или 4-пиридонов(10).
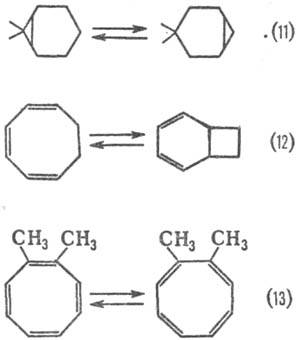
Др. вид таутомерных превращений, протекающих без миграции атома или группы атомов,-валентная таутомерия-обратимое взаимопревращение валентных изомеров. Последние представляют собой изомеры, к-рые можно перевести друг в друга в результате перераспределения связей (см. Изомерия). К валентной таутомерии можно отнести нек-рые сигматропные перегруппировки (11),. электроциклические реакции (12), кольчато-кольчатые перегруппировки (13).
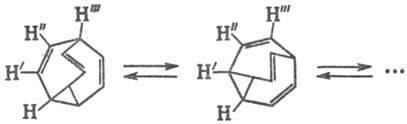
Известно довольно большое число примеров валентной таутомерии для сложных каркасных структур, напр. для сноутена:
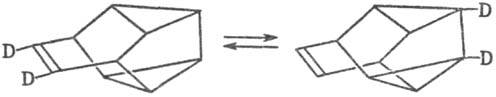
Классич. пример валентной таутомерии-существование в результате сигматропных перегруппировок (по механизму топомери-зации) 1,2· 106 (по расчетам) таутомеров у бульвалена (перегруппировка Коупа). Перестройка такой системы представляет собой непрерывный процесс:
Лит.: Кольцов А. И., Хейфец Г.М., "Успехи химии", 1971, т. 40, в. 9, с. 1646; Ингольд К., Теоретические основы органической химии, пер. с англ., М., 1973, с. 658; Минкин В. И., Олехнович Л. П., Жданов Ю. А., Молекулярный дизайн таутомерных систем, Ростов н/Д., 1977. Г. В. Гришина.
