Таутомерия
Соответственно строению нитрилов и изонитрилов можно было бы ожидать, что и отвечающее им водородное соединение должно существовать в двух структурно-изомерных формах:
Н—C≡N и Н—N=C
Однако существует лишь одно соединение этого состава, называемое цианистоводородной или синильной кислотой. У солей синильной кислоты также неизвестны изомеры. Если же такие соли вступают в реакции, ведущие к образованию производных синильной кислоты, в которых место атома водорода занимает радикал, то получаются производные как одной формы, так и другой, т. е. нитрилы и изонитрилы; иногда получаются одновременно обе формы, а иногда исключительно или почти исключительно одна из форм. Таким образом, синильная кислота и ее соли ведут себя так, как будто они обладают сразу двумя строениями, что, казалось бы, противоречит теории строения
А. М. Бутлерова. Как будет показано ниже, это противоречие только кажущееся.
В очень сходных отношениях находятся между собой нитросоединения и изонитросоединения и многочисленные другие вещества.
Это явление, которое впервые правильно истолковал А. М. Бутлеров (1877), было впоследствии названо таутомерией.
При таутомерных превращениях всегда изменяется характер связей (простых и кратных), откуда происходит второе название этих явлений — десмотропия. Эти изменения характера связей для системы, состоящей из атома водорода и двух атомов А и В, можно в общем виде представить следующим образом
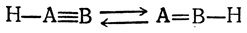
а для системы из атома водорода и трех атомов А, В и С:
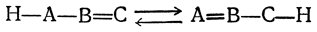
Для всех этих случаев характерна подвижность атома водорода, точнее — протона; последний легко перемещается от одного атома к другому и обратно. При переходе протона электронные пары, с помощью которых протон связывается с этими атомами, не меняют своей принадлежности.
А. М. Бутлеров предположил, что в основе явлений таутомерии лежит быстрое взаимное превращение молекул обоего рода; следовательно, вещества, реально существующие в подобных случаях в жидком и газообразном состоянии, представляют собой равновесную смесь таких превращающихся друг в друга молекул. Другое объяснение таутомерии выдвигал Лаар, допускавший, в противоположность взглядам А. М. Бутлерова, возможность особого, как бы двойного, строения вещества, при котором атомы водорода, подобно кометам в планетной системе, переходя из сферы притяжения одного атома в сферу притяжения другого атома, совершают колебания между этими атомами. Позднейшие исследования целиком подтвердили точку зрения А. М. Бутлерова. Как будет видно из дальнейшего, в большинстве случаев явление таутомерии действительно сводится к особенно легкому взаимному превращению двух изомерных форм, часто идущему самопроизвольно.
В ряде случаев, например для нитросоединений и изонитросоединений, для которых раньше была известна лишь одна основная форма, впоследствии были открыты изомерные формы. Однако никаких указаний на возможность выделения изомеров синильной кислоты (так же как и азотистой) пока не имеется. Тем не менее есть основания предполагать, что синильная кислота также представляет собой равновесную смесь двух изомеров
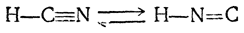
что, однако, трудно обнаружить из-за чрезвычайно больших скоростей их взаимного превращения.
Изонитрильное строение придавал синильной кислоте и ее солям еще Неф, основывавшийся на том; что синильная кислота, подобно карбиламинам, сильно ядовита и обладает интенсивным запахом.
Величина теплоемкости синильной кислоты показывает, что синильная кислота, действительно, представляет собой смесь указанных выше изомеров с сильным преобладанием при невысоких температурах нитрильной формы (более 99%). Изучение спектров комбинационного рассеяния света также приводит к заключению о наличии в синильной кислоте второго изомера в небольшом количестве.
Вопрос о строении солей синильной кислоты остается не вполне ясным. Исследование структур кристаллов цианидов некоторых металлов показало, что узлы кристаллических решеток у них заняты атомами металлов и группами CN, причем расстояния Me—С и Me—N одинаковы. Это обстоятельство не позволяет считать, что металл связан преимущественно с углеродом или преимущественно с азотом. В растворах же цианиды реагируют, по-видимому, в ионной форме, а потому на основании их реакций, например с галоидными алкилами, этот вопрос тем более не может быть решен.
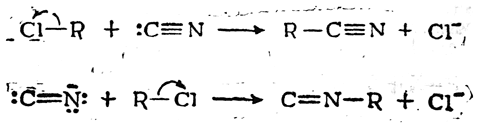
В зависимости от условий ион цианида может вступать в реакцию в одной из двух форм:
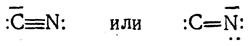
В первом случае положительный конец диполя у галоидного алкила будет ориентироваться к углеродному атому, в результате чего будет получаться нитрил, а во втором случае — к атому азота, образуя изонитрил: