Протон
ПРОТОН (от греч. protos- первый), стабильная элементарная частица, входящая в состав всех ядер атомов хим. элементов; ядро атома самого легкого изотопа водорода 1Н (протия). Обозначается р. Масса протона mp = 1,6726485(86)x x10-27кг; в атомных единицах массы (а.е.м.) 1,007276470(11); в энергетич. единицах ~938,3 МэВ. Масса протона в ~ 1836 раз больше массы покоя электрона и немного меньше массы mn нейтрона: mn — mp = 1,29344 МэВ. Элект-рич. заряд протона положителен, по абс. величине он равен заряду электрона 1,6021892 (46)·10-19Кл [или 4,803242(14)·10-10 СГСЭ ед. заряда]; уд. заряд протона очень высок-9,578756(27)x x 107·Кл/кг. Спин протона равен 1/2ђ (ђ-постоянная Планка), магн. момент mр = 2,792763(30)mN, где mN- ядерный магнетон.
Число протонов в ядре атома данного хим. элемента равно атомному номеру этого элемента и определяет место элемента в периодической системе химических элементов. Соотв. все хим. св-ва простых в-в и соединений, образуемых данным элементом, связаны с числом протонов в ядре атома. Термин "протон" ввел Э. Резерфорд в нач. 20-х гг. 20 в.
Согласно классификации элементарных частиц, протон относится к адронам, он входит в класс тяжелых частиц-барионов (протон-самый легкий из барионов). Протон участвует в сильных взаимод., а также во всех др. фундам. взаимод.: электромагнитном, слабом и гравитационном. В сильном взаимодействии протон и нейтрон имеют идентичные св-ва и рассматриваются как разл. квантовые состояния одной элементарной частицы-нуклона. За счет слабых взаимод. в радиоактивных ядрах возможно превращение протона в нейтрон п, позитрон е+ и нейтрино v: p:n + e+ + v, а также превращение нейтрона в протон, электрон е- и антинейтрино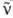 : n:р+е- +
: n:р+е- +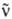 (см. Радиоактивность). Стабильность протонов позволяет использовать их как бомбардирующие частицы для осуществления ядерных реакций, причем протоны предварительно ускоряют до высоких скоростей.
(см. Радиоактивность). Стабильность протонов позволяет использовать их как бомбардирующие частицы для осуществления ядерных реакций, причем протоны предварительно ускоряют до высоких скоростей.
В химии роль протонов особенно велика в кислотно-основном взаимодействии. Согласно разработанной И. Брёнстедом в 1923 теории к-т и оснований, к-ты-это в-ва, способные отдавать протоны, а основания-в-ва, способные принимать протоны (см. Кислоты и основания). Из-за высокого уд. заряда свободные протоны не могут существовать в жидких средах; в водных р-рах. протон претерпевает гидратацию. Протоны, входящие в состав разл. протонных р-рителей, принимают участие в хим. процессах, протекающих в р-рах; р-рители, не содержащие таких протонов, наз. апротонными. Важное значение во мн. хим. р-циях имеет присоединение протонов к молекуле в-ва, напр. при нейтрализации, электроф. присоединении и замещении, образовании ониевых соед. (см. Протонирование). Р-ции кислотно-основного катализа зачастую включают стадию переноса протона от субстрата (к-ты или основания) к катализатору, К-рая наз. протолизом. С. С. Бердоносов
