Двойственная реакционная способность и таутомерия
До недавнего времени было общепринятым считать таутомерию единственной причиной двойственной реакционной способности органических веществ. Это положение схематически можно выразить следующим образом: если вещество А дает два ряда производных (А' и В'), то оно таутомерно веществу В, и производное В' образуется не из А, а из В:
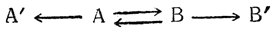
Однако во многих случаях никакими из существующих методов не удается обнаружить наличие второго таутомера. Это обстоятельство послужило причиной возникновения понятия псев-
домерии. Псевдомерными называют такие таутомерные смеси, в которых концентрация одного из таутомеров (например, В) «исчезающе мала», но он обладает значительно более высокой реакционной способностью, чем А, и производное B' все-таки образуется из В, а не из А. Однако М. И. Кабачник показал, что в случае сильно смещенного в сторону А равновесия
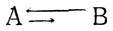
образование В' из В не всегда возможно.
Превращение равновесной смеси
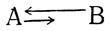
в В' по схеме псевдомерного превращения
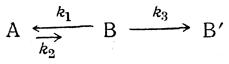
должно идти медленнее, чем прямое превращение А→В' при той же начальной концентрации [А]. Если константа таутомерного равновесия

весьма мала (ниже 10–10), то скорость образования В' по схеме В→В' вследствие ничтожной концентрации [В] будет крайне низкой. Образование В' из В могло бы протекать с измеримой скоростью только в том случае, если бы константа k3 реакции В→В' была необычайно велика, например порядка
1010—1012 моль–1 ∙ сек–1 для мономолекулярных превращений и 1010—1011 моль–1 ∙ сек–1 для бимолекулярных. Однако столь большие константы скорости реакций в органической химии возможны только для ионов или радикалов, но не для молекул. Следовательно, при таутомерных равновесиях, сильно смещенных в сторону А (KT<10–10), практически В' не может получаться из В и возможно образование В' только непосредственно из А.
Если же равновесие А↔В не сильно смещено (нижний предел KT порядка 10–6—10–8), то оно является не псевдомерным, а обыкновенным таутомерным равновесием, когда присутствие формы В может быть доказано и ее концентрация измерена. Следовательно, не остается места для псевдомерии как явления, обусловливающего двойственную реакционную способность за счет необычайно высокой реакционной способности таутомера, содержащегося в «исчезающе малой» концентрации.
Если и существуют такие, столь сильно смещенные равновесия, что мы не можем обнаружить в них присутствие второго таутомера из-за недостаточной точности существующих методов, то во всяком случае этот второй таутомер, присутствующий в столь ничтожной концентрации, к двойственной реакционной способности вещества практически не имеет никакого отношения. В действительности двойственная реакционная способность таутомерных веществ с сильно смещенным равновесием обусловлена параллельным течением реакций по двум возможным направлениям: без переноса реакционного центра и с переносом реакционного центра. Оба ряда производных А' и В' возникают не из В, а из А:
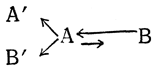
Примерами реакций подобного рода могут служить реакции альдоксимов и кетоксимов, изатина, амидов карбоновых кислот, а также α-аминопиридина.
Таким образом, явление двойственной реакционной способности шире явления таутомерии. Двойственная реакционная способность возможна как вследствие таутомерии, так и вследствие переноса реакционного центра.


