Амиды карбоновых кислот
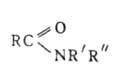
АМИДЫ КАРБОНОВЫХ КИСЛОТ [от ам(миак)], ацилпроизводные аммиака или аминов, соед. общей ф-лы RC(O)NR'R". Незамещенные у атома N амиды RCONH2 наз. первичными; моно- и дизамещенные амиды RCONHR' и RCONR'R" (R' и R"-opr. остаток) - соотв. вторичными и третичными. Соед., содержащие две ацильные группы у атома азота RCON(R')COR", наз. имидами, а соединения с тремя ацильными группами RCON(COR')COR" - триациламинами. По др. классификации соед., содержащие одну, две или три ацильные группы, наз. соотв. первичными, вторичными или третичными. Циклич. аналогами амидов являются лактамы. Об амидах суль-фокислот см. Сульфамиды.
Названия первичных амидов производят от названий соответствующих к-т, напр. НСОNН2-формамид, или амид муравьиной к-ты, СН3СОNH2-ацетамид, или амид уксусной к-ты, С6Н5СОNН2 - бензамид, или амид бензойной к-ты. В названиях N-замещенных амидов заместители перечисляются перед названием незамещенного амида, напр. HCON(CH3)2 - N.N-диметилформамид.
Кроме жидких формамида и N-метил-формамида, первичные и вторичные амиды-кристаллич. в-ва, большинство третичных-жидкости. Низшие алифатич. амиды хорошо раств. в воде, простейшие ароматические - умеренно в горячей воде. Между молекулами амидов, содержащими хотя бы один атом Н при атоме N, возникают водородные связи.
В ИК-спектрах первичных амидов имеются две полосы поглощения, характерные для своб. NH2 - группы, ок. 3500 и 3400 см-1 и две полосы, характерные для группы С=О, при 1690-1630 см-1 (т. н. амкдная полоса I) и 1620-1590 см-1 (амидная полоса II). Вторичные амиды имеют одну полосу поглощения NH-группы в области 3460-3420 см-1 и две полосы поглощения группы С=О в областях 1690-1630 и 1550-1510 см-1. У третичных амидов - одна полоса поглощения группы С=О ("амид I") в области 1670-1630 см-1. В спектре ЯМР сигналы протонов NH2-группы проявляются в интервале от 5 до 8 м. д. в шкале
Вследствие частичной двоесвязанности N=C и, следовательно, затруднения своб. вращения вокруг связи С(О)—N амиды могут существовать в цис- и транс-формах: 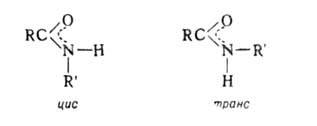
В водных р-рах амиды обычно имеют нейтральную р-цию, что обусловлено сопряжением своб. электронной пары атома N с двойной связью карбонильной группы: 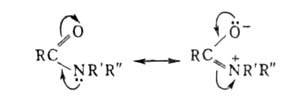
Однако первичные и вторичные амиды могут проявлять слабые амфотерные св-ва, а третичные - слабые основные. Так, с сильными минер. к-тами они образуют непрочные легко гидролизующиеся соли. Основные св-ва N-алкилзаме-щенных амидов выражены сильнее, чем у незамещенных. Напр., N,N-диметилацетамид образует с НС1 соль, устойчивую в виде конц. водных р-ров, а с НС1О4 и H2PtCl6 - прочные хорошо кристаллизующиеся соли. В среде уксусного ангидрида амиды количественно оттитровываются р-ром НС1О4. При взаимод. с щелочными металлами у первичных и вторичных амидов атом Н аминогруппы замещается металлом, образуя, напр., RCONHNa.
При кипячении с конц. водными р-рами минер. к-т или щелочей амиды гидролизуются до к-т. Под действием HNO2 легко дезаминируются: RCONH2 + HNO2 -> RCOOH + N2 + H2O. Восстанавливаются до аминов RCH2NR'R" натрием в спиртовой среде, алюмогидридом Li или Н2 - над меднохромовыми катализаторами. Первичные амиды дегидратируются до нитрилов под действием Р2О5, А12О3, SiO2, H3PO4 или др.; при действии гипобромитов или гипохлоритов в щелочном р-ре превращаются в первичные амины (Гофмана перегруппировка). Взаимод. вторичных и третичных амидов с РС15, SOC12 и т.п. приводит к имидоилхлоридам RCC1=NR' или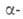 хлориммониевым солям RCC1—
хлориммониевым солям RCC1—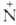 R'R"C1-, которые при нагревании расщепляют- , ся на нитрилы RCN и алкилгалогениды (см. Брауна реакция).
R'R"C1-, которые при нагревании расщепляют- , ся на нитрилы RCN и алкилгалогениды (см. Брауна реакция).
С бромом и хлором амиды образуют соотв. N-бром- и N-хлорамиды, с формальдегидом и окисью этилена-N-метилоламиды, N,N'-метилен-бис-ациламиды и разл. N-оксиэтильные производные амидов, имеющие большое пром. значение, напр.: 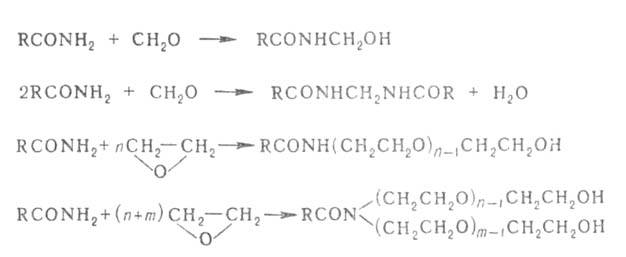
В пром-сти амиды синтезируют взаимод. к-т или чаще их хлорангидридов, ангидридов, эфиров с NH3 (аммонолиз) либо амином (аминолиз). Еще один пром. способ - неполный гидролиз нитрилов в присуг. H2SO4 или Си: RCN + Н2О -> RCONH2. Разработаны непрерывные контактно-каталитич. аммонолиз и аминолиз к-т при 200-280 С в присут. катализаторов дегидратации (А12О3, SiO2 и др.); выход амидов 95-98%.
В'лаб. условиях амиды можно синтезировать также р-цией кетенов с NH3 или амином (напр., СН2=С=О + NH3 -> CH3CONH2), N-алкилзамещенные амиды-взаимод. амидов с алкилгалогенидами, N-алкил- и N-арилзамещенные - с использованием Бекмана перегруппировки или перегруппировки Шмидта: 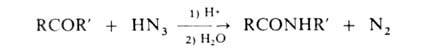
Образование амидов используют для защиты аминогруппы и для идентификации первичных и вторичных аминов (преим. в виде ацетамидов и бензамидов), а также карбоновых к-т (в виде незамещенных амидов, анилидов, бензиламидов). Особое значение методы защиты МН2 - группы имеют в синтезе пептидов (см. Белки).
Амиды - пластификаторы бумаги, искусственной кожи, ПВХ, экстрагенты нек-рых радиоактивных металлов, сырье в произ-ве полимеров, промежут. продукты в синтезе красителей и сульфамидных препаратов и др.
Литература
Бюлер К., Пирсон Д., Органические синтезы, пер. с англ., ч. 2, М.. 1973, с. 384-430; Органикум, пер. с нем., т. 2, М., 1979, с. 84-99; Общая органическая химия, пер. с англ., т. 4, М., 1983, с. 388-536; Kirk-Othmer encyclopedia, 3 ed., v. 2, N.Y.-[a.o.], 1978, p. 252-59. H.K. Садовая.
