Сульфамиды
СУЛЬФАМИДЫ (амиды сульфокислот, сульфониламиды, сульфонамиды), соед. общей ф-лы RSO2NR'R:, где R-opг. остаток, R' и R:-H или орг. остаток. Различают незамещенные RSO2NH2, монозамещенные RSO2NHR' и дизамещенные сульфамиды RSO2NR'R:, а также дисульфонамиды (ди-сульфониламины) RSO2NR'SO2R:, трисулъфонамиды (три-сульфониламины) RSO2N(SO2R)2. Известны циклические сульфамиды (сультамы)
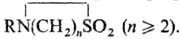
Назв. незамещенных сульфамидов производят от назв. соответствующих сульфокислот, напр. СН3SО2NН2-амид метансуль-фокислоты, или метансульфамид, n-CH3C6H4SO2N(CH3)2-N,N-диметил-n-толуолсульфамид. Ди- и трисульфонамиды часто называют как производные аминов, напр. (CH3SO2)2NH - бис-(метилсульфонил)амин.
Атом S в сульфамидах имеет тетраэдрич. конфигурацию; длины связей, напр., для CH3SO2NH2 0,181 нм (С—S), 0,146 нм (S—О), 0,161 нм (S—N), угол CSN 113°, CSO 106°. Сульфамидные группы в ароматических сульфамидах обладают отрицат. индукционным и мезомерным эффектами; константы Гаммета sмета 0,55, sпара 0,62.
В ИК спектрах незамещенных и монозамещенных сульфамидов присутствуют характеристич. полосы в области 3350-3250 см-1 (своб. группы NH2 и NH, 2 полосы), 1430-1330 см-1 и 1180-1140 см-1 (асимметрические и симметрические валентные колебания группы SO2) и 910-900 см-1 (S—N). В спектре ПМР для незамещенных и монозамещенных сульфамидов хим. сдвиг d 5-8 м.д. (группа NH2) и 7-11 м.д. (группа NH).
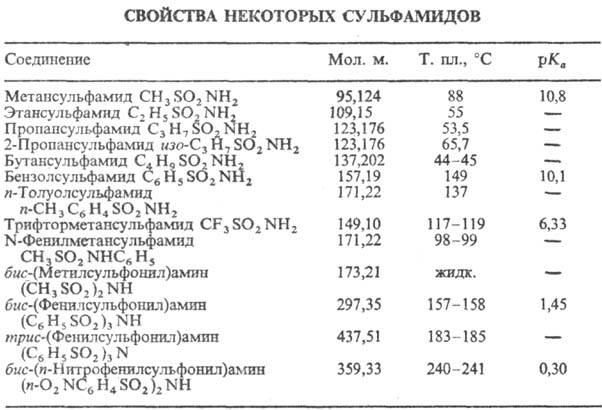
Большинство сульфамидов-бесцв. кристаллич. в-ва, нек-рые алифатические сульфамиды-маслообразные жидкости (см. табл.); умеренно раств. в воде и полярных орг. р-рителях.
Незамещенные и монозамещенные сульфамиды-слабые к-ты, ди-сульфонамиды-значительно более сильные к-ты; последние в водных р-рах щелочей образуют соли, на разл. р-римости к-рых основано разделение первичных, вторичных и третичных аминов (тест Хинсберга).
Водные р-ры минер. к-т гидролизуют сульфамиды с разрывом связи S—N и образованием соответствующих сульфокислот и аминов (в виде аммониевых солей); монозамещенные сульфамиды, содержащие остатки, из к-рых легко образуются карбка-тионы, гидролизуются к-тами с разрывом связи N—С, напр.:
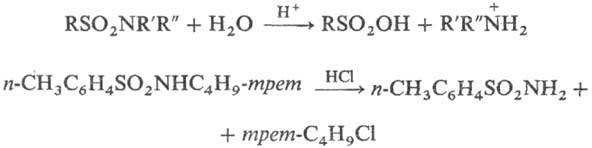
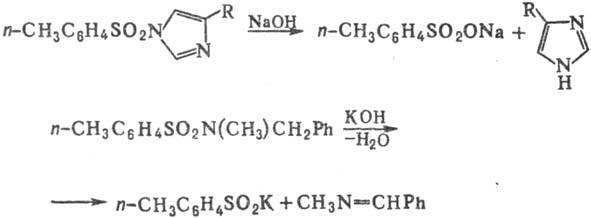
Водные р-ры оснований гидролизуют сульфамиды только в жестких условиях либо в случаях, когда фрагмент NR'R:-легко уходящая группа; при этом образуются своб. амины и соли сульфокислот; нек-рые сульфамиды при действии щелочей дают соли сульфиновых к-т и альдимины, напр.:
Большинство сульфамидов устойчиво к действию восстановителей и окислителей. Исключение составляют нек-рые дизамещен-ные сульфамиды, к-рые при каталитич. гидрировании или при действии LiAlH4, HI, НВг и др. подвергаются восстановит. расщеплению с образованием аминов и производных S(II) и S(IV), а также N-алкилдисульфамиды, расщепление к-рых при действии LiА1Н4 или NaBH4 протекает по связи С—N, напр.:
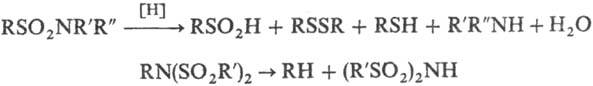
Действию окислителей подвергаются лишь сульфамиды, содержащие остаток азотистого гетероцикла; при этом разрывается связь С—N, напр.:
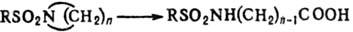 .
.
Под действием HNО2 незамещенные сульфамиды дезаминируются, монозамещенные образуют N-нитрозопроизводные (нек-рые из последних используют для получения диазоалканов):
RSO2NH2 + HNO2 : RSO2OH + N2 + H2O RSO2NHR' + HNO2 : RSO2N(NO)R' + H2O
Взаимод. незамещенных сульфамидов с HNO3 приводит к нитрамидам: RSO2NH2 + HNО3 : RSO2NHNO2 + Н2О.
Ангидриды, хлорангидриды и ариловые эфиры карбо-новых к-т ацилируют незамещенные и монозамещенные сульфамиды с образованием N-ацильных производных; при обработке незамещенных сульфамидов фосгеном образуются сульфонилизоциа-наты, напр.:
RSO2NHR' + R:COX : RSO2N(COR:)R' + НХ
X = Hal, OCOR:, ОАr RSO2NH2 + СОС12 : RSO2NCO + 2HC1
Незамещенные и монозамещенные сульфамиды присоединяются по активир. кратным связям с образованием N-замещенных сульфамидов; с альдегидами и кетонами образуются продукты присоединения по связи С=О, к-рые подвергаются дальнейшим превращениям:
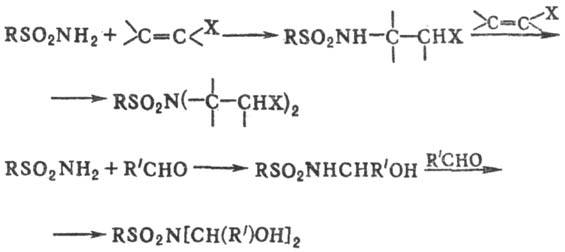
Карбонильные соед., содержащие электроноакцепторные заместители (напр., полигалогеналкильные группы), в при-сут. оснований и дегидратирующих ср-в образуют с незамещенными сульфамидами реакционноспособные сульфонилимины:
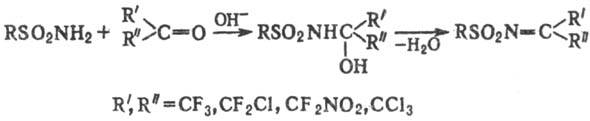
Обработка незамещенных и монозамещенных сульфамидов галогенами (С12, Вr2) в присут. оснований или р-рами гипо-галогенитов щелочных и щел.-зем. металлов приводит к N-галоген- или N,N-дигалогенсульфамидам; соли N-гa-логенсульфамидов широко применяют в пром-сти, медицине, военном деле (см. Хлорамины), напр.:
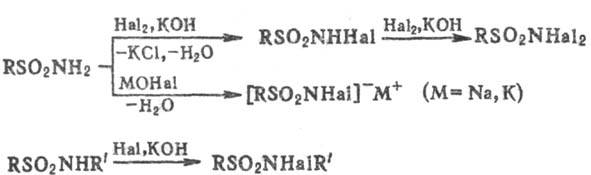
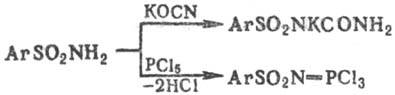
При взаимод. незамещенных ароматических сульфамидов с KOCN или с мочевиной образуются карбаминовые производные сульфамидов (в виде солей), а при взаимод. с РСl5-трихлорфосфазо-сульфониларены, напр.:
Осн. пром. метод получения сульфамидов - аммонолиз или аминолиз ангидридов, галогенангидридов и эфиров сульфокислот.
Сульфамиды получают также окислением сульфенамидов или суль-финамидов Н2О2, К2Сr2О7, КМnО4 либо взаимод. солей сульфиновых к-т с N-хлораминами:

Для получения дизамещенных сульфамидов используют переамидирование, напр.: 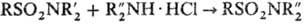 +
+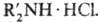
Незамещенные сульфамиды могут быть получены взаимод. нек-рых диазосоед. с SO2 в присут. NH3; амидированием сульфиновых к-т гидроксиламином или сульфокислот ацет-амидом; восстановлением сульфонилазидов Н2 или изо-С3Н7ОН при УФ облучении, напр.:
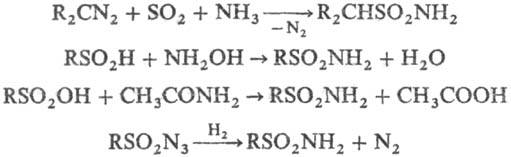
Ароматические сульфамиды получают взаимод. ароматич. углеводородов с производными серной к-ты:
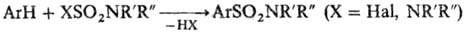
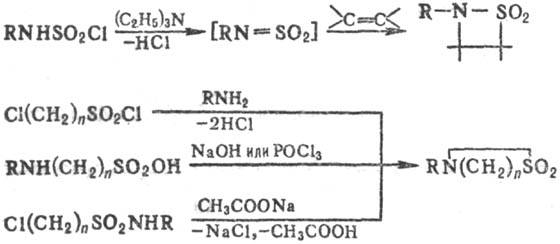
b-Сультамы получают по р-ции [2 + 2]-циклоприсоеди-нения к N-сульфониламинам, g- и d-сультамы- циклизацией разл. соед., напр.:
Для синтеза ди- и трисульфамидов используют сульфонилирование солей сульфамидов хлорангидридами сульфокислот, напр.:
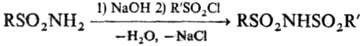
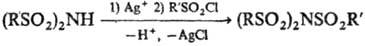
Сульфамиды-промежут. продукты в произ-ве лекарств (см. Сульфаниламидные препараты), дезинфицирующих ср-в, дегазирующих в-в, красителей, оптич. отбеливателей, пластификаторов.
См. также Бензолсульфамиды, Толуолсулъфамиды.
Лит.: Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 528-35; Methodicum Chimicum, v. 7-Main Group elements and their compounds, pt В, N. Y., 1978, p. 710-14. И.И. Крылов.
