Сульфохлориды
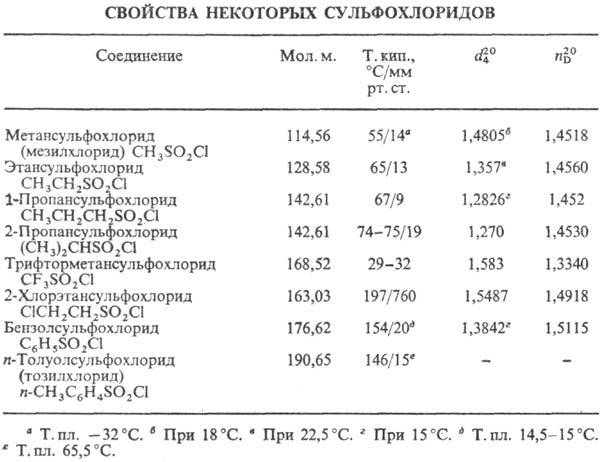
СУЛЬФОХЛОРИДЫ (сульфонилхлориды, хлорангидриды сульфокислот), соединения общей формулы RSO2Cl, где R-opг. остаток. Жидкие или твердые в-ва (см. табл.); низшие алифатические и ароматические сульфохлориды обладают неприятным резким запахом, не раств. или трудно раств. в воде, раств. в диэтиловом эфире, ацетоне, СНСl3, ССl4, спиртах, бензоле.
Сульфохлориды называют, добавляя к назв. соединения-основы окончание "сульфохлорид", напр. бензолсульфохлорид.
Атом S в сульфохлоридах имеет тетраэдрич. конфигурацию; связи S—О почти двойные, напр. длины связей для C6H5SO2Cl 0,1417 нм (S—О), 0,176 нм (С—S), 0,2047 нм (S—Cl), углы CSCl 100,4°, CSO 110°, OSO 122,5°. Группа SO2Cl обладает отрицательными индукционным и мезомерным эффектами.
В ИК спектрах сульфохлоридов присутствуют две характеристич. полосы в области 1375-1340 и 1190-1160 см-1, соответствующие асимметрическим и симметрическим валентным колебаниям группы SO2.
При нагревании выше температуры кипения сульфохлориды, особенно ароматические, разлагаются с выделением SO2; в воде и в к-тах довольно устойчивы, в присут. оснований легко гидролизуются до сульфокислот. Р-ция сульфохлоридов с нуклеоф. реагентами приводит к продуктам замещения атома С1, в присут. третичных аминов промежуточно генерируются сульфены, напр.:
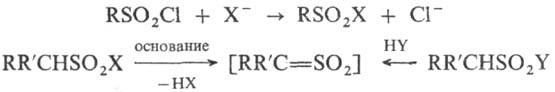
R, R' = Н, Alk, Ar, Ac и др. X и Y = ОН, OR, SR, Hal, NH2, NR2, N3 и др.
При присоединении сульфохлоридов к ацетиленам в присут. солей Си образуются ненасыщенные b-хлорсульфоны; при восстановлении металлами в нейтральной среде-соли суль-финовых к-т; в кислой среде или под действием LiAlH4-тиолы; с ароматич. соединениями в условиях реакции Фриделя-Крафтса-сульфоны либо, если при отрыве SO2 образуется стабильный карбкатион, продукты алкилиро-вания, напр.:
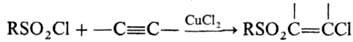
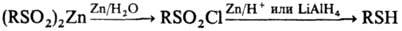
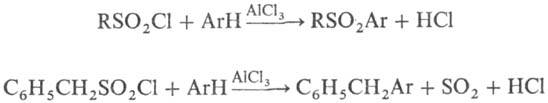
В промышленности сульфохлориды получают взаимод. алифатич. углеводородов с SO2Cl2 или смесью SO2 и Сl2 в газовой или жидкой фазе под действием света либо в присутствии инициаторов радикальных р-ций; ароматические сульфохлориды-обработкой соответствующих углеводородов хлорсульфоно-вой кислотой.
Сульфохлориды могут быть получены окислит. хлорированием тйолов, сульфидов, дисульфидов, ксантогенатов и др.; окислением сульфенилхлоридов; взаимод. сульфокислот и их производных (солей, эфиров, амидов, гидразидов) с РСl5, СОСl2, SOCl2, Cl2, ClSO2OH. Сульфохлориды образуются также при р-ции магнийорг. соединений с SO2Cl2 или диазониевых солей с SO2 и CuCl2.
Применяют сульфохлориды в произ-ве моющих ср-в, ионообменных смол, эластомеров, лек. ср-в, красителей, инсектицидов и гербицидов; в качестве полупродуктов в синтезе эфиров сульфокислот; как мягкие алкилирующие агенты в орг. синтезе.
Сульфохлориды раздражают слизистые оболочки глаз и верхних дыхательных путей, при попадании на кожу или при нахождении в атмосфере, содержащей пары или аэрозоли, сульфохлориды вызывают дерматиты. Лакриматоры (особенно ненасыщенные сульфохлориды). Вдыхание паров может привести к отеку легких. С увеличением мол. массы раздражающее действие сульфохлоридов ослабевает,
См. также Бензолсульфохлориды, Метансульфохлорид, То-луолсульфохлориды.
Лит.: Джильберт Э. Е., Сульфирование органических соединений, пер. с англ., М., 1969; Общая органическая химия, пер. с англ., т. 5, М., 1983. с. 519-22; Houben-Weyl, Methoden der organischen Chemie, Bd 9, Stuttg., 1955; "Methodicum Chimicura", v. 7, pt B, Stuttg., 1977. Я. И. Крылов.
