Тиолы
ТИОЛЫ (меркаптаны, тиоспирты), содержат в молекуле меркаптогруппу —SH (сульфгидрильную группу), непосредственно связанную с орг. радикалом. В статье рассмотрены алифатические и алициклические тиолы, об ароматических тиолах см. Тиофенолы.
Атом S в меркаптогруппе имеет гибридизацию, промежуточную между sp2 и sp3; длины связей, напр., для СН3SН(нм) 0,1817 (С—S), 0,1329 (S—H), угол CSH 96,5°. Энергия связи S—H 360 кДж/моль. Группа SH обладает слабым отрицат. индукционным и положит. мезомерным эффектами; константы Гаммета sмета 0,25, shara 0,15. Кислотные св-ва ее выше, а основные ниже, чем группы ОН.
Названия тиолов производят прибавлением к названию соответствующего углеводорода суффикса "тиол", напр. СН3SН-метантиол, С6Н11SН -циклогексантиол.
Низшие алифатические тиолы обладают резким неприятным запахом, к-рый обнаруживается при очень низких концентрациях (до 2·10-9 мг/л). Тиолы кипят при более низких т-рах, чем их кислородные аналоги, что обусловлено меньшей склонностью к самоассоциации (см. табл.).
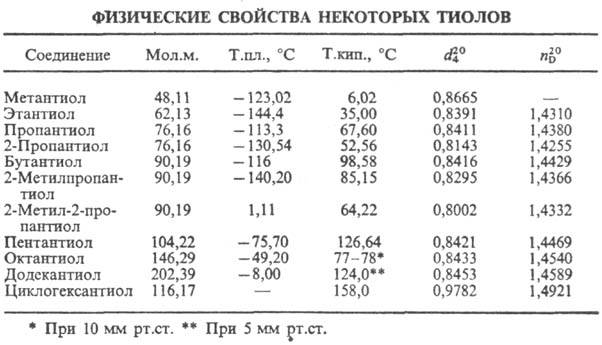
В разб. р-рах тиолы существуют в виде мономеров, а в более концентрированных-в виде димеров преим. линейного строения благодаря образованию водородных связей S—H...S; в жидком и твердом состоянии могут образовывать полимеры.
Для тиолов характерна линейная зависимость термодинамич. величин от мол. массы. Энергия диссоциации связи С—SH в тиолах для: CH3SH 293,3; C2H5SH 289,1; C3H7SH 284,9; mpem-C4H9SH 272,35 кДж/моль. Для CH3SH потенциал ионизации 9,44 эВ, с удлинением цепи понижается. В ИК спектрах тиолов присутствует характеристич. полоса 2572 см-1, соответствующая валентным колебаниям группы SH; в спектрах комбинац. рассеяния характеристич. частоты 703, 1428 и 2572 см-1. В спектре ПМР хим. сдвиг (d) протона группы SH 1-2 м.д.; электроноакцепторные заместители смещают сигнал в более слабое поле.
Тиолы-слабые к-ты, рКа 10-11 (25 °С, вода), кислотность с удлинением и разветвлением алифатич. цепи понижается, при введении электроноакцепторных заместителей повышается. Для замещенных метантиолов RCH2SH значения рКа коррелируют с индукц. константами Тафта s*: рКа = = 10,22 - 3,50s*.
Хим. св-ва тиолов определяются наличием подвижного атома водорода и неподеленных пар электронов у атома S. Для тиолов характерна высокая нуклеофильность в сочетании с относительно низкой основностью. В качестве нуклеофилов тиолы замещают атомы или группы у насьпц. атома углерода, присоединяются к алкенам и алкинам.
Тиолы легко окисляются. При действии О2 в щелочной среде, иода, o-иодбензойной к-ты, алифатич. сульфоксидов, акти-вир. МnО2, Н2О2 и N2О4 образуются дисульфиды RSSR (в присут. металлов-Сu, Со, Ni-p-ция протекает по радикальному механизму); (СН3СОО)4Рb в спирте окисляет тиолы до сульфинатов RSOOCH3, галогены в водной среде-до сульфонилгалогенидов RSO2Hal, НКО3-до сульфокислот RSO3H.
В газовой фазе при 400 °С тиолы разлагаются на H2S и соответствующий олефин.
Гетеролитич. присоединение тиолов к активир. олефинам идет обычно в присут. оснований и протекает против правила Марковникова, для 1,1-диалкилэтиленов оно идет в присут. к-т и по правилу Марковникова, напр.:
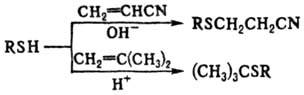
Против правила Марковникова присоединяются к олефинам также тиильные радикалы, генерируемые из тиолов под действием УФ облучения, в присут. пероксидов, диазосоед. и др.
Замещенные ацетилена реагируют с тиолами либо по правилу Марковникова, либо против него, напр.:
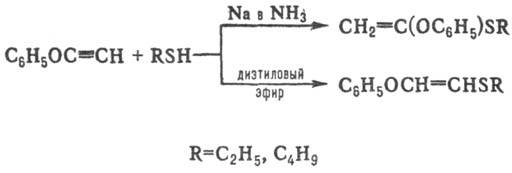
Р-ция тиолов с ацетиленами стереоспецифична.
Взаимодействие тиолов с нитрилами в кислых средах приводит к иминотиоэфирам, напр.:
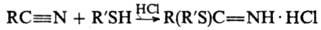
При действии тиолов на альдегиды или кетоны в присут. кислых катализаторов образуются соответствующие тио-ацетали или тиокетали:
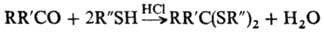
Мн. р-ции тиолов протекают по ионному механизму с участием тиолат-анионов, обладающих сильными нуклеоф. св-вами. Тиолат-анионы генерируются из тиолов в р-рах NaOH, триэтаноламина, пиридина и др., а также образуются при взаимод. эфиров тиолов (напр., CH3COSR) с сильными основаниями в неводных средах либо при гидролизе тиомочевины.
Тиолат-анионы легко замещают атомы галогена (обычно Сl) в галогенидах В, Si, Sn, Ge, P, Мо и др., напр.:
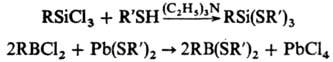
Р-ции тиолат-анионов с алкилхлоридами протекают в жидком NH3, с гексахлор- и гексафторбензолом - в среде этиленгликоля или пиридина (гексабромбензол с тиолат-анионами не реагирует), напр.:

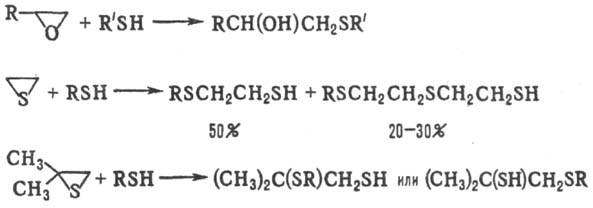
В основных или нейтральных средах тиолы расщепляют оксирановые или тиирановые циклы, напр.:
Ацилирование тиолов в присут. оснований приводит к S-ациль-ным производным, напр.:
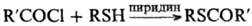
При обработке тиолов нитрозирующими агентами (NOC1, HNO2) образуются неустойчивые тионитриты RSNO, обладающие характерной окраской (цветная проба на тиолы).
Осн. методы синтеза: 1) взаимод. NaSH или KSH с алкилирующими агентами [RI, ROSO3H, (RO)2SO2 и др.]. 2) Присоединение H2S к алкенам (ур-ние 1); в присут. катализаторов (металлы, оксиды или сульфиды металлов, к-ты, S) р-ция протекает по правилу Марковникова, при УФ облучении-против правила. 3) Пропускание паров спирта и H2S над ТhO2 или Аl2О3 (2); тиолы образуются также при взаимод. спиртов (обычно C4-C16) с P4S10 (выход выше 70%). 4) Для получения b-замещенных тиолов используют расщепление оксиранового цикла (или этиленимина) H2S (3) либо тииранового цикла разл. агентами (4).
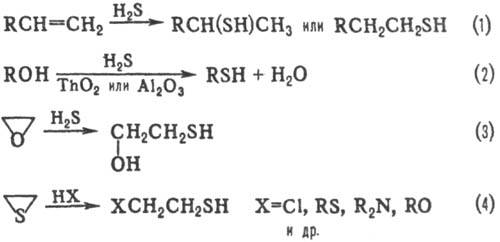
Тиолы могут быть получены также р-цией тиолкарбоновых к-т с алкенами или алкилгалогенидами с послед. гидролизом образующихся тиоэфиров (5); конденсацией алкилгалогенидов с тиомочевиной и далее щелочным гидролизом изо-тиурониевой соли (6) либо конденсацией алкилгалогени-дов с Na2S2O3 и кислотным гидролизом S-алкилтиосуль-фатов (т. наз. солей Бунте; см. Тиосульфаты органические) (7).
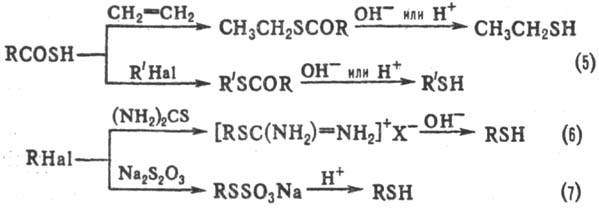
Др. методы получения: взаимод. алкилгалогенидов с ксантогенатами щелочных металлов с послед. щелочным гидролизом или восстановлением LiAlH4 образующихся алкил-ксантогенатов (ур-ние 8), кислотный гидролиз или восстановление тритиокарбонатов (9); щелочной гидролиз дитио-карбаматов, получаемых взаимод. алкилхлоридов с N,N-диметилдитиокарбаматом Na (10); восстановление тионов, получаемых из кетонов и P4S10; восстановление диалкил-дисульфидов LiAlH4, NaBH4, Zn-Hg в H2SO4, PPh3 в CH3OH.
В пром-сти низшие тиолы получают взаимод. спиртов с H2S в присут. катализаторов при 300-350 °С; трет-алкантиолы C8-C16-взаимод. непредельных углеводородов с H2S в присут. А12О3 при 100-135 °С и давлении 3,5-7 МПа. С 1982 начато пром. выделение низших тиолов из высокосернистого прир. газа.
Низшие тиолы (С2-С3) используют в качестве одорантов топливных газов, для получения пестицидов (напр., пер-хлорметилмеркаптан CCl3SCl); метантиол-для произ-ва метионина; тиолы C8-C16-регуляторы полимеризации в произ-ве латексов, каучуков.
Тиолы, являющиеся ловушками для радикалов, используют для защиты от радиации и как антиокислители, напр. додекантиол—стабилизирующая добавка для каучуков.
Мировое произ-во тиолов 200 тыс. т/год (1986), из них CH3SH более 20 тыс. т/год, тиолов С2-С8 и выше-более 100 тыс. т/год.
Лит.: Прилежаева E. H., Шостаковский М, F., "Успехи химии", 1963, т. 32, в. 8, с. 897-947; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 130-51; Большаков Г. Ф., Сераорганические соединения нефти, Новосиб., 1986; Houben-Weyl, Methoden der organischen Chemie, Bd 9, Stuttg., 1955; The chemistry of the Tiol Group, ed. by S. Patai, N. Y., 1974. Э. H. Дерягина.
