Потенциал ионизации
ПОТЕНЦИАЛ ИОНИЗАЦИИ частицы (молекулы, атома, иона), минимальная разность потенциалов U, к-рую должен пройти электрон в ускоряющем электрич. поле, чтобы приобрести кинетич. энергию, достаточную для ионизации частицы. Потенциал ионизации частицы X с образованием частицы X' соответствует процессу:
X + е : X' + 2е.
Более общее понятие-энергия ионизации Е, миним. энергия, необходимая для удаления электрона из частицы на бесконечность. Она связана с потенциалом ионизации соотношением:
E=Ue,
где е-элементарный электрич. заряд. Энергия ионизации является св-вом частицы и не зависит от способа удаления электрона, тогда как потенциал ионизации, строго говоря, лишь характеристика исторически первого метода ионизации электронным ударом (см. Ионы в газах). Энергия ионизации, выраженная в эВ, численно совпадает с потенциалом ионизации, выраженным в В.
Различают первый, второй и т.д. потенциалы ионизации, соответствующие удалению из частицы первого, второго и т.д. электронов. Второй потенциал ионизации нейтральной частицы X совпадает с первым потенциалом ионизации иона Х+ и т.д. Первый потенциал ионизации отрицат. иона Х-совпадает со сродством к электрону частицы X.
Для атомов понятия первого, второго и т. д. потенциала ионизации относят к ионизации невозбужденного атома с образованием невозбужденного положит. иона. Для молекул различают адиабатический потенциал ионизации и вертикальные потенциалы ионизации Адиабатический потенциал ионизации отвечает процессу, при к-ром из молекулы, находящейся в основном состоянии, в результате ионизации образуется положит. мол. ион также в основном состоянии. Вертикальные потенциалы ионизации характеризуют ионизацию молекул, при к-рой образующийся мол. ион может находитья в произвольном энергетич. состоянии (электронном и колебательном), причем соответствующие квантовые переходы происходят без изменения межъядерных расстояний (рис. 1).
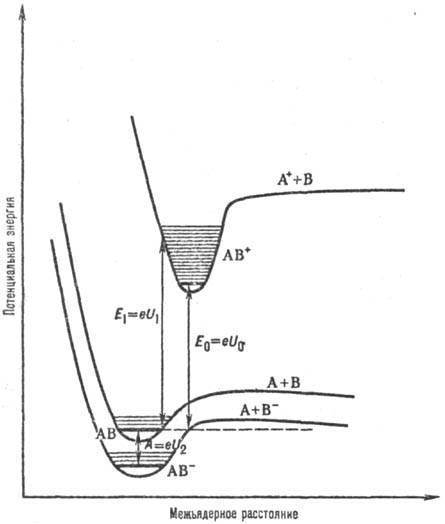
Рис. 1. Кривые потенц. энергии для основных электронных состояний молекулы АВ и ионов АВ+ и АВ-. U0 - первый адиабатам, потенциал ионизации молекулы АВ (E0-энергия ионизации); U1- первый вертикальный потенциал ионизации молекулы АВ (Е1- соответствующая энергия ионизации), A-адиаба-тич. сродство к электрону молекулы АВ (U2-адиабатич. потенциал ионизации иона АВ-).
Возможно термодинамич. определение потенциала ионизации атомов и адиабатического потенциала ионизации молекул через стандартную энтальпию DH0 р-ции X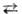 Х+ + е при абс. нуле т-ры:
Х+ + е при абс. нуле т-ры:
DH0 = NAE = NAUe,
где NA-постоянная Авогадро.
Первые потенциалы ионизации известны для атомов всех элементов перио-дич. системы и нсск. тыс. молекул. У легких атомов с зарядом ядра Z < 10-15, как правило, надежно определены все потенциалы ионизации (первый, второй и т.д. до Z); у более тяжелых атомов-неск. начальных потенциалов ионизации. В изменении первых потенциалов ионизации атомов явно выражена периодичность при увеличении Z. При движении слева направо по периоду потенциал ионизации, вообще говоря, постепенно увеличивается; при увеличении Z в пределах подгруппы потенциал ионизации уменьшается (рис. 2).
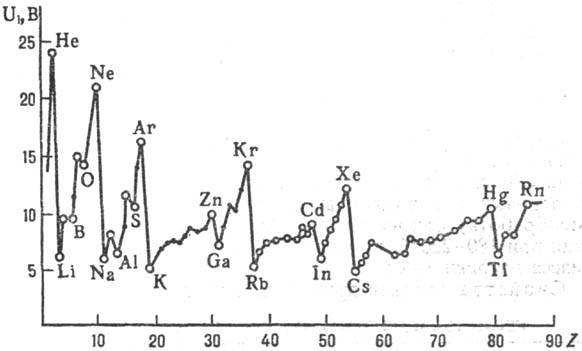
Рис. 2. Зависимость первых потенциалов ионизации U1 атомов хим. элементов от атомного номера Z.
Осн. совр. методы определения потенциалов ионизации: фотоэлектронная спектроскопия, фотоионизация, изучение ионно-молекулярных реакций, поверхностная ионизация. Наилучшая точность определения потенциалов ионизации атомов и простейших молекул достигается при использовании спектроскопич. данных по сходимости серий спектральных линий. Для сложных молекул предпочтительнее фотоэлектронная спектроскопия (достигаемая точность до b0,001 эВ). Следует, однако, иметь в виду, что этот метод в общем случае дает значения вертикальных, а не адиабатического потенциала ионизации На потенциал ионизации атомов и атомных ионов оказывает влияние, помимо Z, экранирующий эффект нижележащих электронных уровней. Минимальные первые потенциалы ионизации имеют щелочные металлы: Cs 2,893 В, Li 5,390 В; максимальные - благородные газы: Не 24,580 В, Rn 10,745 В. Известные потенциалы ионизации молекул-это величины от 5 до 20 В (см. табл.).

В кон. 70-х гг. 20 в. обнаружены т. наз. суперщелочи-молекулы с экстремально низкими значениями потенциалов ионизации: ОК4 (3,62 В), ОК3 (3,65 В), ClNa2 (4,15 В) и др.
При переходе от валентных электронов атома к остовным потенциал ионизации резко увеличивается. Так, для Be U1 9,320 В, U2 18,206 В, U3 153,850 В.
Квантовомех. расчеты потенциалов ионизации для атомов, двух- и трехатомных молекул дают значения, близкие по точности к экспериментальным. Точность расчета в целом зависит от метода; так, для многоатомных молекул в рамках метода мол. орбиталей она обычно не превышает 1 эВ (см. Купманса теорема).
Потенциал ионизации вместе со сродством к электрону определяет величину электроотрицательности атомов и молекул. Знание потенциалов ионизации необходимо для расчетов термохим. процессов в иони-зир. газах и плазме (газоразрядные приборы, магнитогид-родинамич. генераторы, процессы в верх. слоях атмосферы и т.п.).
Лит.: Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. Справочник, под ред. В. Н. Кондратьева, М., 1974; Аллен К. У., Астрофизические величины, пер. с англ., М., 1960; Степанов Н. Ф., Пу-пышев В. И., Квантовая механика молекул и квантовая химия, М., 1991.
