Тиильные радикалы
ТИИЛЬНЫЕ РАДИКАЛЫ, соед. общей ф-лы RS•(R-H, орг. или неорг. остаток); высокореакционноспособные соед., в своб. виде не выделены. Неспаренный электрон на атоме S находится на высшей связывающей мол. орбитали, что обусловливает электроф. св-ва. Тиильные радикалы обладают большим сродством к электрону, чем оксильные радикалы RO•, и в отличие от них легко рекомбинируют при низких т-рах. Для простейшего тиильного радикала HS• 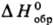 133,56-146,54 кДж/моль; у алкилтиильных радикалов
133,56-146,54 кДж/моль; у алкилтиильных радикалов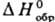 понижается с ростом длины и разветвленности алкильной цепи и составляет для CH3S• 129,8 кДж/моль, для C4H9S• 62,8 кДж/моль, для (CH3)2CS• 46,05 кДж/моль; для PhS•
понижается с ростом длины и разветвленности алкильной цепи и составляет для CH3S• 129,8 кДж/моль, для C4H9S• 62,8 кДж/моль, для (CH3)2CS• 46,05 кДж/моль; для PhS•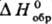 213,53 кДж/моль.
213,53 кДж/моль.
Тиильные радикалы стабилизируются электронодонорными и дестабилизируются электроноакцепторными заместителями.
В спектрах ЭПР тиильные радикалы наблюдается одиночная линия, для AlkS• g-фактор 2,0074, для PhS* 2,008; при введении изотопа 33S-квартетное расщепление, константы сверхтонкого взаимод. = 1,475 мТл.
Величина g-фактора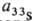 (параллельного) для AlkS• составляет 2,158 и м. б. использована для их идентификации. Величины g-факторов (перпендикулярного и параллельного) для PhS• (генерирован при УФ облучении PhSSPh) соотв. 2,006 и 2,012 при — 200 °С. Для идентификации тиильных радикалов используют также спиновых ловушек метод.
(параллельного) для AlkS• составляет 2,158 и м. б. использована для их идентификации. Величины g-факторов (перпендикулярного и параллельного) для PhS• (генерирован при УФ облучении PhSSPh) соотв. 2,006 и 2,012 при — 200 °С. Для идентификации тиильных радикалов используют также спиновых ловушек метод.
Тиильные радикалы присоединяются к кратным связям и отрывают атом H от молекул орг. соединений. Скорость этих процессов зависит от полярных эффектов вследствие высокого сродства тиильных радикалов к электрону и от прочности образующейся связи S—Н. Р-ция отрыва атома H (RS• + HR' : RSH + •R') чувствительна к стерич. затруднениям в молекулах и радикалах.
Наиб. подробно изучены св-ва тиильных радикалов в р-циях присоединения к непредельным соединениям. Тиильные радикалы атакуют центр с наиб. электронной плотностью в молекуле замещенного этилена и присоединяются к ней против правила Марков-никова; р-ция протекает по цепному механизму:
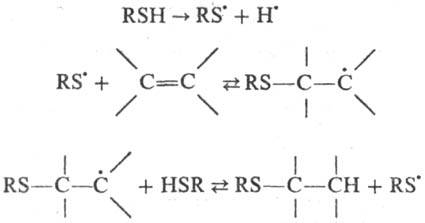
Последние 2 р-ции экзотермичны, что способствует быстрому развитию цепи.
Тиильные радикалы, генерируемые термически из H2S и его производных, замещают атом галогена в галогенаренах и галогенолефи-нах, напр.:
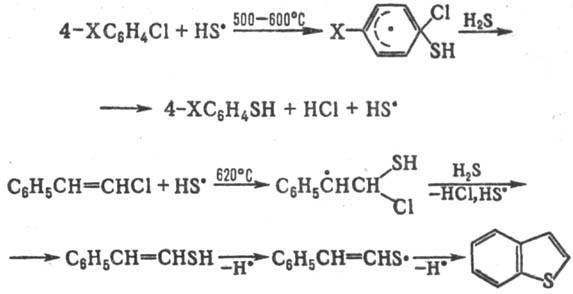
"Ловушками" тиильных радикалов в термин, процессах могут служить также ацетиленовые соединения.
Образуются тиильные радикалы при фотолизе, радиолизе и термолизе H2S и его производных (тиолов, сульфидов, дисульфидов, тионитритов и др.), а также при действии на эти соед. инициаторов (пероксидов, диазосоед. и др.).
Используют тиильные радикалы в качестве регуляторов радикальной полимеризации и процессов пиролиза углеводородов. Они инициируют термич. превращения соед. др. типов и применяются в орг. синтезе.
Лит.: Уоллинг Ч., Свободные радикалы в растворе, пер. с англ., М., 1960; Нонхибел Д., Уилтон Дж., Химия свободных радикалов, пер. с англ., М., 1977; Воронков М. Г., Дерягина Э. Н., "Успехи химии", 1980, т. 59, в. 8, с. 1338; Гасанов Р. Г., Фрейдлина Р. X., там же, 1987, т. 56, в. 3, с. 477.
М. Г. Воронков.
