Радикалы свободные
РАДИКАЛЫ СВОБОДНЫЕ, хим. частицы с неспаренными электронами на внеш. орбиталях; обладают парамагнетизмом и высокой реакц. способностью.
Радикалы свободные могут быть короткоживущими (время жизни доли секунды) или долгоживущими (до неск. лет), нейтральными или заряженными (см. Ион-радикалы), иметь один или большее число неспаренцых электронов (напр., бирадикалы), быть твердыми, жидкими или газообразными в-вами. Стабильность радикалов свободных определяется скоростями их рекомбинации или диспропорционирования.
Все радикалы условно делят на две группы -p- и s-элект-ронные. У первых неспаренный электрон преим. локализован на 2p- или p-орбитали, а соответствующие атомные ядра находятся в узловой плоскости этой орбитали. К p-элект-ронным относятся алкильные, аллильный и бензильный радикалы, а также ион-радикалы ароматич. углеводородов, циклооктатетраена, дивинила и подобных частиц, напр.:
[(CH3)2NC6H4NH2]+; [(NC)2C=C(CN)2]-:
У s-электронных радикалов свободных неспаренный электрон преим. локализован на s-орбитали таким образом, что радикал практически сохраняет электронную конфигурацию исходной молекулы. К таким радикалам свободным относят фенильный, ванильный и формильный радикалы, а также карбоксильный и пиридильный ион-радикалы (соотв.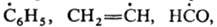
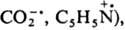 к-рые имеют плоскую конфигурацию. В эту же группу радикалов свободных входят многочисл. хим. частицы с пирамидальным парамагнитным центром (напр.,
к-рые имеют плоскую конфигурацию. В эту же группу радикалов свободных входят многочисл. хим. частицы с пирамидальным парамагнитным центром (напр.,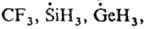
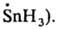
Короткоживущие радикалы свободные. К таким радикалам относятся атомы и сложные хим. частицы с локализованными неспаренными электронами (своб. валентностями), напр.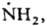
 Для стабилизации таких радикалов свободных используют низкие т-ры, применяя в качестве хладагентов жидкие Не, Н2, N2 или Аr. В застеклованных инертных р-рителях при низких т-рах радикалы свободные стабилизируются, находясь в т. наз. замороженном состоянии (см. также Клетки эффект). В разл. твердых прир. и синтетич. материалах (напр., в орг. и неорг. стеклах) радикалы свободные стабилизируются в результате уменьшения диффузионной подвижности.
Для стабилизации таких радикалов свободных используют низкие т-ры, применяя в качестве хладагентов жидкие Не, Н2, N2 или Аr. В застеклованных инертных р-рителях при низких т-рах радикалы свободные стабилизируются, находясь в т. наз. замороженном состоянии (см. также Клетки эффект). В разл. твердых прир. и синтетич. материалах (напр., в орг. и неорг. стеклах) радикалы свободные стабилизируются в результате уменьшения диффузионной подвижности.
Для генерирования короткоживущих радикалов свободных используют разл. физ. и хим. методы воздействия на в-во, напр. фотолиз, радиолиз, пиролиз, электролиз.
Образование радикалов свободных при электролизе может осуществляться в условиях Кольбе реакции, напр.:
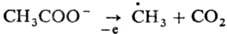
При фотолизе энергия светового кванта, поглощаемого в-вом, должна быть равной или превышать энергию диссоциации (Eд) хим. связи молекулы, напр.:
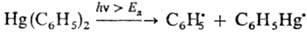
В условиях импульсного фотолиза генерируют короткоживущие радикалы свободные, выход к-рых может достигать 100%.
Легкость термин, распада молекул на радикалы свободные также зависит от энергии диссоциации соответствующей хим. связи. В качестве источников нестабильных радикалов свободных часто используют орг. пероксиды, напр. бензоилпероксид, трет-бутилгидроперок-сид, кумилпероксид, трет-бутилпероксид (см. Инициаторы радикальные). Последний, напр., удобен для генерирования радикалов свободных в р-рах при умеренных т-рах:
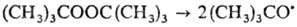
mpem-Бутоксильные радикалы легко осуществляют отрыв атома Н от молекул углеводородов, поскольку связь О—Н в mpem-бутаноле прочнее связи С—Н:
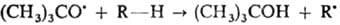
Сольватация радикалов свободных в р-рах обычно изменяет их электронное строение, геометрию и реакц. способность. Нек-рые радикалы свободные могут существовать только в р-рах, находясь в термодина-мич. равновесии с молекулами. Напр., при растворении в воде соли Фреми образуется темно-фиолетовый р-р гидратир. анион-радикала 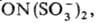 св-ва к-рого на воздухе при 25°С практически не изменяются в течение мн. часов.
св-ва к-рого на воздухе при 25°С практически не изменяются в течение мн. часов.
Пример мол.-индуцир. генерирования радикалов свободных-спонтанная полимеризациястирола:
Долгоживущие радикалы свободные. Такие радикалы обладают сильно делокализованными неспаренными электронами и обычно стерически экранированными реакц. центрами.
Очищенные образцы нек-рых арилметильных радикалов представляют собой устойчивые на воздухе при 25 °С ярко окрашенные кристаллы или аморфные в-ва с содержанием неспаренных электронов ок. 6-10 спин/моль (показатель, характеризующий содержание парамагнитных частиц). Уникальной термостабильностью и хим. стойкостью обладают 1,3-бис-(бифенилен)-2-(4-изопропилфенил) аллил - кристаллы ярко-зеленого цвета (т. пл. 189°С) ,и т. наз. инертные радикалы, напр. (С6С15)2СС1, (С6С15)3С, (С6С15)2СС6С14ОН-высокоплавкие в-ва оранжево-красного цвета.
Радикалы свободные этого типа образуют сольватные комплексы, к-рые существуют в р-рах в термодинамич. равновесии с молеку-лами-димерами. Таким образом ведут себя трифенилметил и его многочисл. аналоги (см. табл.). Для сложных сопряженных систем на состояние равновесия в р-рах между радикалами свободными и их димерами, кроме сольватац. факторов, оказывают влияние мезомерные и стерич. эффекты.

Ароксильные радикалы представляют собой интермедиаты окисления фенолов. Известны лишь единичные примеры высокоочищенных в-в этого типа, напр. гальвиноксильный радикал (ф-ла I; т. пл. 158°С) и индофеноксил (II; т. пл. 136°С).
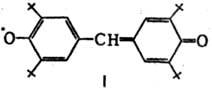
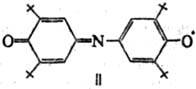
Ароксильные радикалы свободные лишь условно можно назвать долгоживу-щими, т. к. в норм. условиях они быстро реагируют с кислородом, и поэтому операции с такими в-вами обычно проводят в инертной атмосфере или с использованием вакуумной техники.
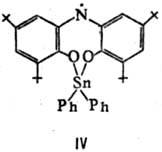
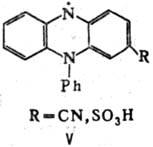
Устойчивые на воздухе при 25 °С радикалы свободные аминильного ряда обычно получают путем окисления вторичных аминов. Известны, напр., темно-синие., кристаллы 1,3,6,8-тетра-трет-бутил-9-карбазила (III; т. пл. 145°С) и соед. IV (т. пл. 216 °С), а также вишнево-красные замещенные феназинильные радикалы свободные (V).
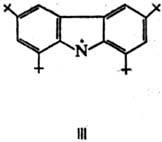
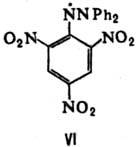
Долгоживущие гидразильные радикалы представляют собой устойчивые на воздухе интенсивно окрашенные кристаллы. Типичное в-во этой группы - N,N--дифенил-N'-пикрил-гидразильный радикал (VI; фиолетовые кристаллы, т. пл. 137-138 °С).
Выраженная тенденция радикалов свободных этой группы к сольватации создает трудности при получении очищенных образцов этих в-в с постоянными физ.-хим. характеристиками.
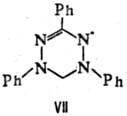
Вердазильные радикалы относятся к числу наиб. стабильных орг. парамагнетиков. Периоды полупревращения нек-рых из них на воздухе при 25 °С составляют мн. годы. Характерный представитель этой группы радикалов свободных- 1,3,5-три-фенилвердазил (VII; темно-зеленые кристаллы, т. пл. 143 °С).
Нитроксильные радикалы традиционно наз. азотокисями или нитроксидами из-за их формального сходства с тривиальными оксидами аминов. Представитель этой группы-т. наз. порфирексид представляет собой р-римые в воде кир-пично-красные кристаллы; его строение м. б. представлено суперпозицией неск. валентно-таутомерных структур, напр.:
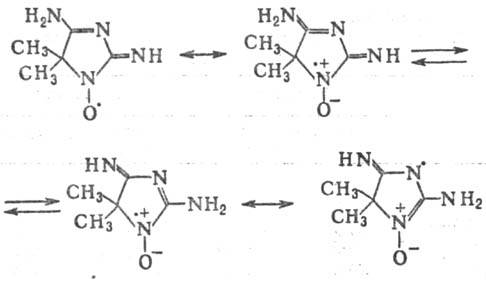
Выраженная делокализация неспаренного электрона (тер-модинамич. фактор) и стерич. экранирование реакц. центров (кинетич. фактор) объясняют стабильность в норм. условиях мн. нитроксильных радикалов свободных ароматич., жирно-ароматич. и гете-роциклич. типа таких, напр., как 4,4'-диметоксидифенилнит-роксил (VIII; т. пл. 161 °С), 2,6-диметоксифенил-трет-бу-тилнитроксил (IX; т. пл. 102°С) и нитроксиднитроксильный радикал имидазолинового ряда (X; т. пл. 100 °С).
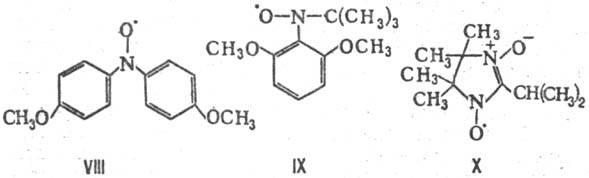
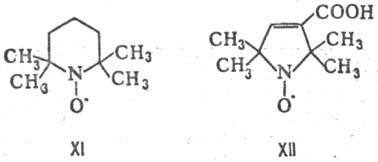
Нек-рые нитроксильные радикалы свободные несмотря на наличие сильно локализованного неспаренного электрона исключительно стабильны на воздухе, напр. темно-красный 2,2,6,6-тетра-метилпиперидин-1-оксил (XI; т. пл. 38 °С) и желтый 2,2,5,5-тетраметил-3-карбоксипирролин-1-оксил (XII; т. пл. 211 °С).
Иминоксильные радикалы (алкилидениминоксильные радикалы) представляют собой частицы общей ф-лы 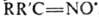 напр. ди-трет-бутилметилениминоксил
напр. ди-трет-бутилметилениминоксил 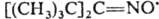 (жидкость бирюзового цвета; т. пл. —21 °С,
(жидкость бирюзового цвета; т. пл. —21 °С, 1,4452). Радикалы этого типа могут существовать в виде двух изомеров -син и анти:
1,4452). Радикалы этого типа могут существовать в виде двух изомеров -син и анти:
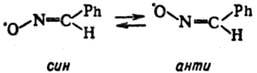
Синтез долгоживущих радикалов свободных осуществляют разнообразными методами, включая одноэлектронные окислит.-восстано-вит. и региоселективные р-ции без затрагивания парамагнитного центра (подробнее см. статьи об отдельных группах долгоживущих радикалов свободных). Т. обр., напр., получают спин-меченые реагенты, высокомол. радикалы и др.
Реакционная способность радикалов свободных определяется гл. обр. наличием своб. валентности, благодаря к-рой они могут вступать в р-ции радикального замещения, присоединения, распада, изомеризации, рекомбинации и диспропорционирования (см. Радикальные реакции).
Необычными являются нерадикальные региоселективные р-ции, в к-рых неспаренные электроны не участвуют в образовании новых хим. связей (р-ции без затрагивания парамагнитного центра). Такие р-ции особенно характерны для нитроксильных радикалов.
Методы обнаружения и анализа. Осн. специфич. методы обнаружения и исследования строения радикалов свободных основаны на использовании спектроскопии электронного парамагнитного резонанса. Спектры ЭПР дают информацию о хим. строении радикалов свободных, степени делокализации неспаренного электрона, о распределении спиновой плотности по разл. атомам частицы. Методом ЭПР можно обнаружить радикалы в концентрации 10-9 моль/л.
Для изучения структур сложных радикалов свободных используют метод двойного электрон-ядерного резонанса (ДЭЯР). Р-ры с высокими концентрациями радикалов свободных могут быть исследованы с использованием спектров ЯМР (особенно когда константы сверхтонкого взаимод. в спектрах ЭПР малы). Для изучения гомолитич. распада молекул в р-рах, взаимод. радикальных пар и др. используют метод химической поляризации ядер
Для идентификации и исследования радикалов свободных используют также спектры в видимой и ультрафиолетовой областях, ИК спектры и спектры комбинац. рассеяния (часто в сочетании с импульсным фотолизом), а также масс-спсктрометрию.
Хим. методы исследования широко используют для определения долгоживущих радикалов свободных. В качестве хим. индикаторов короткоживущих радикалов свободных можно использовать мономеры (напр., стирол), к-рые в присутствии парамагнитных частиц полимеризуются (метод Циглера).
Для идентификации и исследований короткоживущих радикалов свободных их превращают в долгоживущие (обычно в нитроксильные) при взаимод. парамагнитных частиц, напр., с нитронами или нитрозосоед. (т. наз. спиновых ловушек метод).
Короткоживущие радикалы свободные  можно определять с помощью C(NO2)4, к-рый при взаимод. с ними превращ. в нитроформ CH(NO2)3, существующий в водных р-рах в виде интенсивно окрашенного аниона. Последний количественно определяется колориметрич. методами.
можно определять с помощью C(NO2)4, к-рый при взаимод. с ними превращ. в нитроформ CH(NO2)3, существующий в водных р-рах в виде интенсивно окрашенного аниона. Последний количественно определяется колориметрич. методами.
Применение, нахождение в природе. Долгоживущие радикалы свободные (гл. обр. нитроксильные) находят широкое применение в качестве ингибиторов полимеризации и окисления разл. орг. материалов, напр. для стабилизации акрилонитрила, винил-ацетата, винилиденхлорида, стирола, фурфурола, СК и НК, жиров и масел. Их применяют также в молекулярно-биол. исследованиях в качестве спиновых меток и зондов (см. Липидные зонды, Спинового зонда метод), в судебно-мед. диагностике, аналит. химии, для повышения адгезии полимерных покрытий, при изготовлении фотоматериалов, в приборостроении, в геофизике и дефектоскопии твердых тел, напр. алмазов. Короткоживущие радикалы свободные-промежут. частицы, во мн. орг. р-циях (радикальное галогенирование и др.).
Контролируемое ферментами образование радикалов свободных в живых организмах происходит и в процессах нормальной жизнедеятельности, напр. при биосинтезе простагландинов, транспорте электронов в митохондриях, обезвреживании бактерий фагоцитирующими клетками. Образованием в организме активных радикалов свободных объясняют процессы старения. Различные радикалы свободные обнаружены в космосе.
Существование радикалов свободных постулировалось в 19 в. Первый долгоживущий радикал свободный [трифенилметил (С6Н5)3С•] обнаружен в р-ре в 1900 М. Гомбергом. В 1901 О. Пилоти и Б. Шверин получили нитроксильный радикал гетероциклич. природы порфирексид, но не идентифицировали его как радикал свободный. В 1911-22 Г. Виландом разработана химия ароматич. нитроксильных радикалов и диариламинильных радикалов.
Впервые алкильные радикалы (СН3 и СН3СН2) идентифицированы в 1929 Ф. Пакетом. В последующие годы развитие химии радикалов свободных было связано с открытием и использованием для идентификации радикалов метода ЭПР, а также с синтезом разл. групп долгоживущих радикалов свободных.
Лит.: Бучаченко А. Л., Вассерман А. М., Стабильные радикалы, М., 1973; Вертц Дж., Болтон Дж., Теория и практические приложения метода ЭПР, пер. с англ., М., 1975; Походенко В. Д., Белодед А.А., Кошсч-ко В. Д., Окислительно-восстановительные реакции свободных радикалов, К., 1977; Розанцев Э. Г., Шолле В. Д., Органическая химия свободных радикалов, М., 1979; Нонхибел Д., Теддер Дж., Уолтов Дж., Радикалы, пер. с англ., М., 1982; Нитроксильные радикалы. Синтез, химия, приложения, под ред. Э. Г. Розанцева и Р. И. Жданова, М., 1987; Kaiser E., Kevan L., Radical ions, N. Y., 1968; Kochi J. K. (ed.), Free radicals, v. 1-2-4, N.Y., 1973-80; Polymer stabilization and degradation, Wash., 1985; Landolt - Bornstein, New Scries. Numerical data and functional relationships in science and technology. Group II, v. 9, 13, 17, В. 1977-1988. Э.Г. Розанцев.
