Ион-радикалы
ИОН-РАДИКАЛЫ, частицы с нсспаренным электроном и зарядом. По знаку заряда различают катион-радикалы (КР) и анион-радикалы (АР). Ион-радикалы могут быть органическими и неорганическими.Органические ион-радикалы. Практически любая орг. молекула может образовывать как АР (при восстановлении), так и КР (при окислении). Относит. склонность к образованию КР или АР зависит от природы атомов, входящих в молекулу, и от особенностей ее строения. Напр., ароматич. тиоэфиры ArSCH3 дают стабильные КР ArSCH3+' и АР ArSCH3-'. Ароматич. амины преим. образуют КР ArNR2+', а ароматич. кетоны - АР Аr2СО-' (т. наз. кетилы). Устойчивость ион-радикалов возрастает с увеличением степени делокализации неспаренного электрона. Наличие в молекуле электронодонорных групп (OR, NR2, CR=CR2 и др.) повышает стабильность КР, акцепторных (NO2, CN, COOR, SO2R, CF3 и др.) - АР. Нек-рые соли ион-радикалов выделены в твердом виде (см., напр., Металлы органические). В газовой фазе ион-радикалы образуются при электронном ударе, диссоциативной ионизации (см. Маcс-спектрометрия), а также в условиях ион-циклотронного резонанса. Для жидкой фазы общий метод - электрохим. окисление или восстановление. АР получают также р-цией субстратов с сольватированным электроном или донорами электронов, в качестве к-рых используют щелочные и щел.-зем. металлы, др. орг. АР, орг. анионы и нек-рые соед. с низким потенциалом ионизации. В качестве окислителей при получении КР используют H2SO4, к-ты Льюиса (АlСl3, SbCl5 и др.), РbО2, K3[Fe(CN)6], NO+ClO4-, орг. катионы, орг. соед. с высоким сродством к электрону (хиноны, тетрацианоэтилен и др.), стабильные радикалы, напр., ароксильные, нитроксильные, гидразильные. Иногда КР получают восстановлением, напр.:
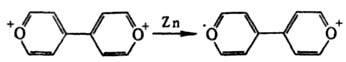
Образованию ион-радикалов при взаимод. донора и акцептора электронов предшествует перенос заряда в донорно-акцепторном комплексе, чему способствует УФ облучение. Ион-радикалы - интермедиаты мн. р-ций; образуются из субстратов в результате одноэлектронного переноса. Для ион-радикалов характерны р-ции фрагментации, напр.:
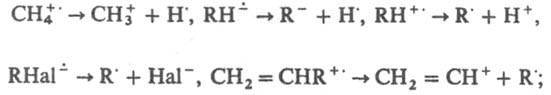
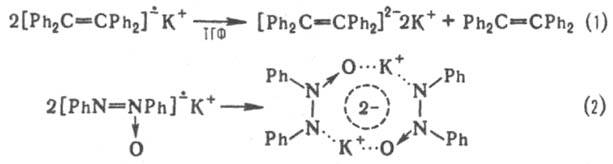
диспропорционирования (р-ция 1) и димеризации (р-ция 2):
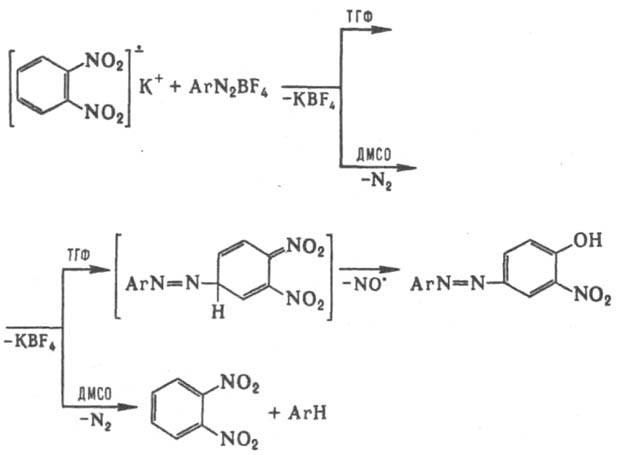
Неорганические ион-радикалы. Наиб. известен АР кислорода
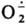 , т. наз. супероксид-ион, входящий в состав КО2 (см. Калий) и образующийся при его диссоциации в непротоногенном р-рителе, напр., бензоле, в присут. 18-краун-6-эфира. Образуется
, т. наз. супероксид-ион, входящий в состав КО2 (см. Калий) и образующийся при его диссоциации в непротоногенном р-рителе, напр., бензоле, в присут. 18-краун-6-эфира. Образуется 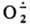 также при электролизе О2 и при одноэлектронном переносе типа:
также при электролизе О2 и при одноэлектронном переносе типа: 
Супероксид устойчив в отсутствие протонов; является умеренно сильным восстановителем и очень слабым окислителем. Его окислит. способность возрастает в присут. сильных протонных к-т. Сильный нуклеофил, реагирует, напр., с ароматич. дисульфидами:
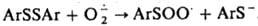 Супероксид выступает как переносчик электрона в процессах дыхания, идущих С участием супероксиддисмутазы. Возможно, что в тканях под действием
Супероксид выступает как переносчик электрона в процессах дыхания, идущих С участием супероксиддисмутазы. Возможно, что в тканях под действием 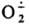 нек-рые прир. антибиотики дают АР, далее превращающиеся в более активные противомикробные и канцеролитич. соед. Так, напр., объясняют образование реумицина из ксантотрицина.
нек-рые прир. антибиотики дают АР, далее превращающиеся в более активные противомикробные и канцеролитич. соед. Так, напр., объясняют образование реумицина из ксантотрицина. 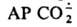 получают электрохим. восстановлением СО2 при потенциале —2 В или из формиат-иона по схеме:
получают электрохим. восстановлением СО2 при потенциале —2 В или из формиат-иона по схеме: 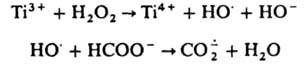
Потенциал восстановления м. б. значительно снижен при использовании в качестве катализатора комплекса Ni с 1,4,8,11-тетраазациклотетрадеканом. Возможно, что
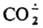 образуется при фотосинтезе.
образуется при фотосинтезе. 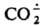 - восстановитель, напр.:
- восстановитель, напр.: 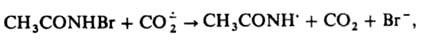
способен присоединяться по кратным связям:
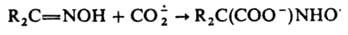
Перспективное св-во
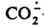 - его способность превращаться в СО, что позволяет получать последний из СО2.
- его способность превращаться в СО, что позволяет получать последний из СО2. 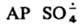 образуется при фотолизе и термолизе р-ров персульфатов или при добавлении к ним солей переходных металлов в низких степенях окисления, напр.:
образуется при фотолизе и термолизе р-ров персульфатов или при добавлении к ним солей переходных металлов в низких степенях окисления, напр.: 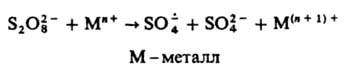
Наиб. эффективна смесь солей Fe2+ и Сu+. С орг. соед.
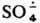 обычно дает КР, напр.,
обычно дает КР, напр., 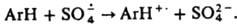 Атом Н при этом обычно не отщепляется. Лит.: Морковник А. С., Охлобыстин О. Ю., "Успехи химии", 1979, т. 48, в. 11, с. 1968-2006; их же, "Химия гстероцикл. соединений", 1980, № 8, с. 1011-29; Росси Р. А., де Росси Р. X., Ароматическое замещение по механизму SRN 1, пер. с англ., М., 1986; Тодрес З. В., Ион-радикалы в органическом синтезе, М., 1986; Julliard М., Chanon М., "Chem. Rev." 1983, v. 83, № 4, p. 425-506. 3. В. Тодрес.
Атом Н при этом обычно не отщепляется. Лит.: Морковник А. С., Охлобыстин О. Ю., "Успехи химии", 1979, т. 48, в. 11, с. 1968-2006; их же, "Химия гстероцикл. соединений", 1980, № 8, с. 1011-29; Росси Р. А., де Росси Р. X., Ароматическое замещение по механизму SRN 1, пер. с англ., М., 1986; Тодрес З. В., Ион-радикалы в органическом синтезе, М., 1986; Julliard М., Chanon М., "Chem. Rev." 1983, v. 83, № 4, p. 425-506. 3. В. Тодрес.
Ещё по теме
Радикальные реакции в химии — механизмы и примеры
Ренийорганические соединения — свойства и получение
Рутенийорганические соединения — строение и применение
Ионы — понятие, свойства и роль в природе и организме
Реакции в растворах — механизмы и влияние растворителя на химические процессы
Окислительно-восстановительный катализ — механизмы и применение
Ионные радиусы в химии и кристаллохимии
Радий — свойства и применение радиоактивного элемента
Окислительно-восстановительные реакции — суть и применение
Свободные радикалы в химии — типы, свойства и применение
Свободные радикалы — типы, свойства и роль в химических и биологических процессах
Родийорганические соединения — особенности и применение
