Физические и химические свойства
Низшие тиоэфиры — нерастворимые в воде жидкости, кипящие выше, чем меркаптаны. Запах чистых сернистых алкилов напоминает запах эфира и не является неприятным.
Сернистые алкилы — вещества нейтральные. На их свойства оказывает влияние склонность серы переходить в соединения высшей валентности.
1. Присоединение галоидов. Галоиды присоединяются к тиоэфирам с образованием кристаллических продуктов состава (CnH2n + 1)2SBr2 и (CnH2n + 1)2SJ2.
2. Присоединение солей тяжелых металлов. Тиоэфиры присоединяют соли тяжелых металлов, образуя соединения типа (C2H5)2S · HgCl2 и (C2H5)2S·HgJ2.
3. Образование сульфоксидов. Действием азотной кислоты тиоэфиры окисляются с образованием окисей сернистых алкилов, или сульфоксидов (окисей сульфидов), R2SO. Это бесцветные, не имеющие запаха кристаллические вещества, не обладающие щелочной реакцией, но являющиеся очень слабыми основаниями; они дают с сильными кислотами (НСl, НВr, HNO3) солеобразные соединения типа R2SO · HCl. Эти соли отчасти разлагаются уже под действием воды (А. М. Зайцев, 1866).
Действием восстановителей сульфоксиды легко вновь превращаются в тиоэфиры.
Если бы мы рассматривали окиси сульфидов как вещества, содержащие четырехвалентную серу, связанную с кислородом двойной связью, то эти вещества следовало бы считать в некоторой степени аналогами кетонов:

Однако они не вступают ни в какие реакции, характерные для двойной связи такого типа: не присоединяют HCN, бисульфитов, при их восстановлении не идет присоединение водорода, а размыкается связь между серой и кислородом и вновь образуются сульфиды.
Измерения величины поверхностного натяжения у окисей сульфидов и определения величины парахора привели в заключению об отсутствии у них двойной связи и о наличии семиполярной связи. В таком случае их строение должно выражаться формулой
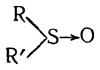
Строение их солеобразных соединений с сильными кислотами следует считать аналогичным строению сульфониевых солей:
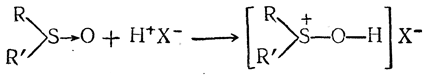
Пространственное расположение заместителей около атома серы в молекуле сульфоксида должно изображаться пирамидой с углами RSO, RSR' и R'SO, близкими к 90—100° (рис. 17). Совершенно очевидно, что при таком
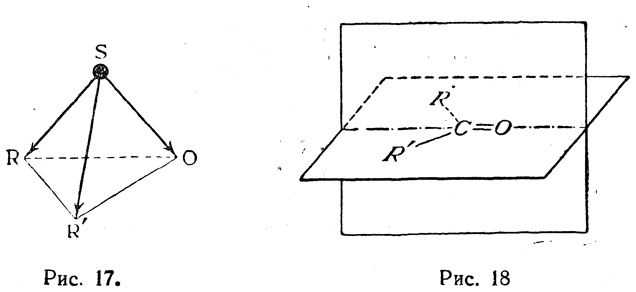
пирамидальном расположении должны существовать две зеркально-симметричные формы и соответствующие вещества должны вращать плоскость поляризации светового луча в противоположные стороны. Наоборот, при наличии двойной связи направления связей радикалов R и R' должны были бы лежать в плоскости, перпендикулярной к плоскости двойной связи, и молекула имела бы плоскость симметрии (как у кетонов, рис. 18), а следовательно не могла бы обнаруживать явлений оптической изомерии. Поэтому получение оптически деятельных форм окисей сульфидов (Филлипс) окончательно подтвердило достоверность строения, изображенного на рис. 17.
4. Образование сульфонов. Дымящая азотная кислота и перманганат окисляют тиоэфиры (и окиси сульфидов) в сульфоны (А. М. Зайцев):
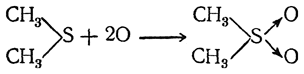
Сульфоны, подобно окисям сульфидов, не вступают в реакции, характерные для соединений, содержащих двойные связи. Поэтому для них также можно предположить строение с семиполярными связями, что хорошо согласуется с их физическими свойствами.
Сульфоны — бесцветные, кристаллические, весьма устойчивые вещества, лишь с трудом поддающиеся действию восстановителей.
Дисульфоны, получаемые окислением тиоацеталей:

имели довольно значительное применение в медицине как снотворные средства. Дисульфон (СН3)2С(SО2С2Н5)2, получаемый из ацетона, называется сульфоналом. Еще более сильным усыпляющим действием обладают соединения:
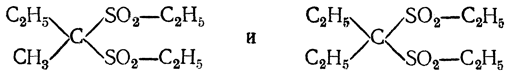
Первое соединение, получаемое из метилэтилкетона, называется трионалом, второе — готовится из диэтилкетона и называется тетроналом.


